1. Introduzione
L’angina pectoris è un sintomo di fondamentale importanza nei pazienti con cardiopatia ischemica in quanto, generalmente, rappresenta il risultato di un’ischemia miocardica secondaria ad una discrepanza tra la richiesta di ossigeno e il supporto ematico fornito.
L’angina viene classificata in stabile e instabile o tipica e atipica sulla base delle caratteristiche cliniche, mentre la sua stadiazione si basa sulla gravità dei sintomi che si verificano in seguito allo sforzo fisico effettuato (Figura 1) (Tabella 1).1
Figura 1. Probabilità pre-test di coronaropatia nei pazienti sintomatici stratificata per età, sesso e tipo dei sintomi
 Adattata da Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77.
Adattata da Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77.
Tabella 1. Classificazioni dell’angina pectoris
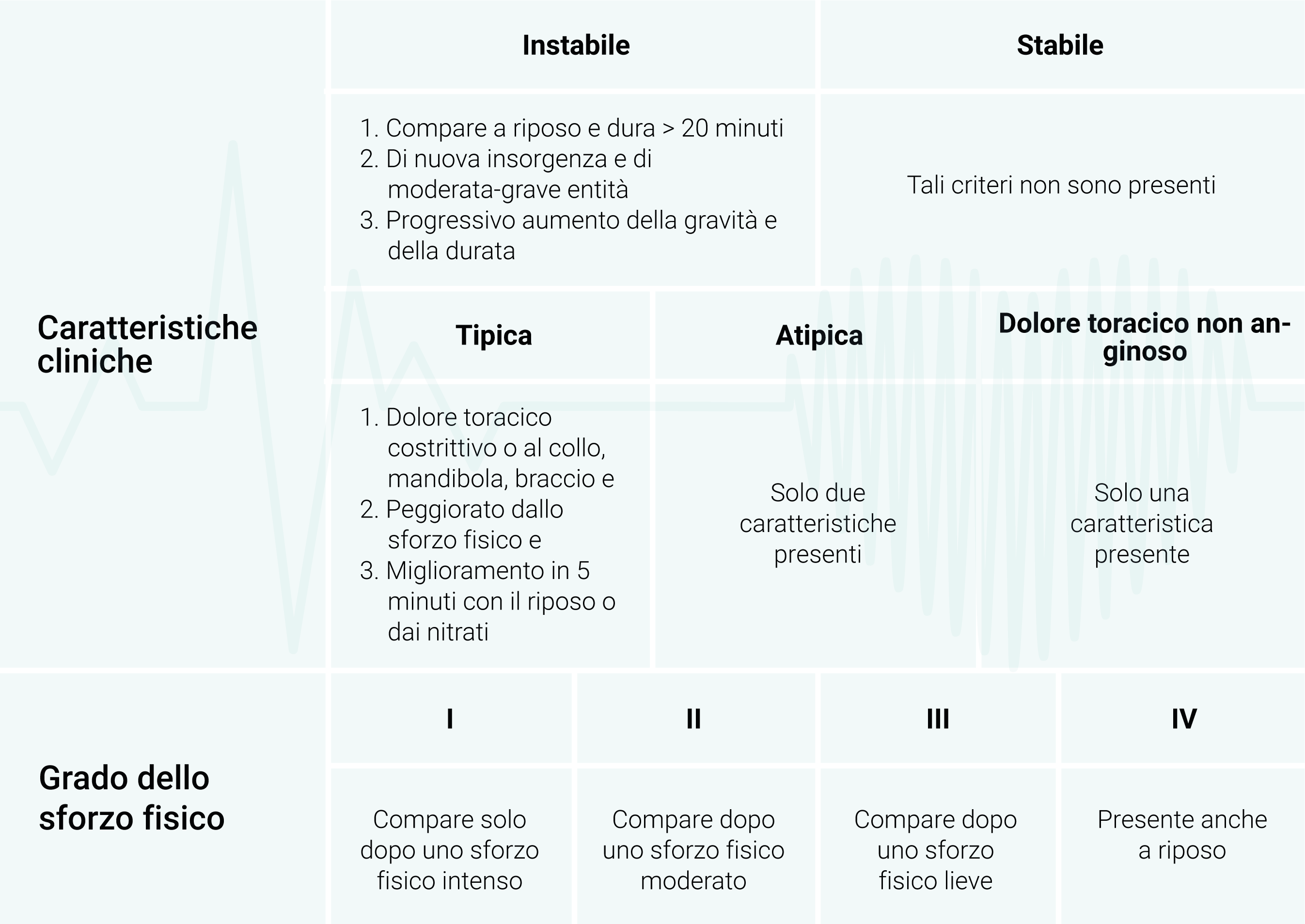 Adattata da Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77.
Adattata da Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77.
La prevenzione e l’eventuale trattamento di tale sintomo con farmaci anti-ischemici rappresenta un cardine della terapia dei pazienti con cardiopatia ischemica.1,2 In tale scenario clinico, i β-bloccanti rappresentano un’utile scelta terapeutica in quanto sono in grado di ridurre la richiesta miocardica di ossigeno.1,2 L’attività simpatica, infatti, gioca un ruolo fondamentale nella modulazione del ritmo cardiaco in risposta a fattori di stress sia fisiologici che patologici.3 Per tali motivi, i β-bloccanti sono stati largamente studiati e sono molto utilizzati nei pazienti con infarto miocardico nei quali hanno dimostrato un ruolo anche nella riduzione del rimodellamento cardiaco e nella prevenzione delle aritmie ventricolari.4
In particolare, l’utilizzo precoce dei β-bloccanti nell’infarto miocardico acuto è stato associato ad una riduzione del danno miocardico e ad un miglioramento clinico, anche nei pazienti trattati con angioplastica coronarica.4 I β-bloccanti sono considerati anche degli efficaci antiaritmici e possono essere utilizzati in particolari condizioni cliniche per la loro capacità di modulare le alterazioni strutturali e funzionali secondarie ad un danno miocardico.3 Ad oggi, infatti, circa l’80% dei pazienti affetti da tali patologie riceve questi farmaci.5
Lo scopo principale di questo documento è quello di fornire delle indicazioni di pratica clinica, da parte di un Panel di Esperti, in grado di indirizzare i clinici nella gestione terapeutica dei β-bloccanti nei pazienti con angina pectoris, infarto miocardico e aritmie cardiache. Le numerose evidenze scientifiche presenti in letteratura, prevalentemente derivanti da studi randomizzati controllati, hanno dimostrato come l’utilizzo di questa classe farmacologica migliori il tasso degli eventi clinici e rappresenti un pilastro irrinunciabile nella gestione del paziente affetto da tali patologie.
2. Metodologia
Per valutare il livello di consenso tra gli Esperti sulla gestione dell’angina pectoris, infarto miocardico e aritmie cardiache con i β-bloccanti in termini di appropriatezza terapeutica nei diversi setting di pratica clinica è stato utilizzato il metodo Delphi modificato.6
A garanzia della bontà delle indicazioni espresse, sono stati costituiti 2 Board di Esperti: un Comitato Editoriale (CE) e un Comitato Scientifico (CS).
I componenti del CE (5 membri), nonché autori del presente manoscritto, hanno redatto, sulla base delle evidenze scientifiche disponibili, una serie di statement che sono stati successivamente valutati dal CS (9 membri). Quest’ultimo, laddove riteneva opportuno, ha avanzato proposte di integrazione/modifica. Sono stati effettuati due round di votazione da parte del CS, in modalità anonima. Anche le eventuali proposte di modifica/integrazione relative ad uno statement specifico sono state oggetto di votazione da parte del CS sempre in modalità anonima.
Per l’approvazione di ciascuno statement è stato scelto a priori un livello di consenso ≥ 75% tra i membri del CS. Gli statement così definiti sono stati oggetto di approvazione finale da parte del CE.
La collaborazione tra il CS e il CE così come l’aderenza al metodo Delphi è stata garantita dal Metodologo designato.
3. Risultati
Sulla base dei dati presenti in letteratura e della propria esperienza clinica, il CE ha proposto un panel iniziale di 15 statement che è stato oggetto di votazione da parte del CS. Tutti gli statement indicati dal CE sono stati approvati dal CS al primo round con una percentuale di consenso > 75%, senza alcuna proposta di modifica/integrazione. Il CS, durante il primo round ha avanzato la proposta, in modalità anonima, di 3 nuovi statement che hanno ottenuto una percentuale di consenso > 75% a seguito di votazione avvenuta durante il secondo round. Quindi, nel complesso sono stati approvati 18 statement (Tabella 2).
Tabella 2. Risultati riepilogativi in seguito ai due round del metodo Delphi modificato
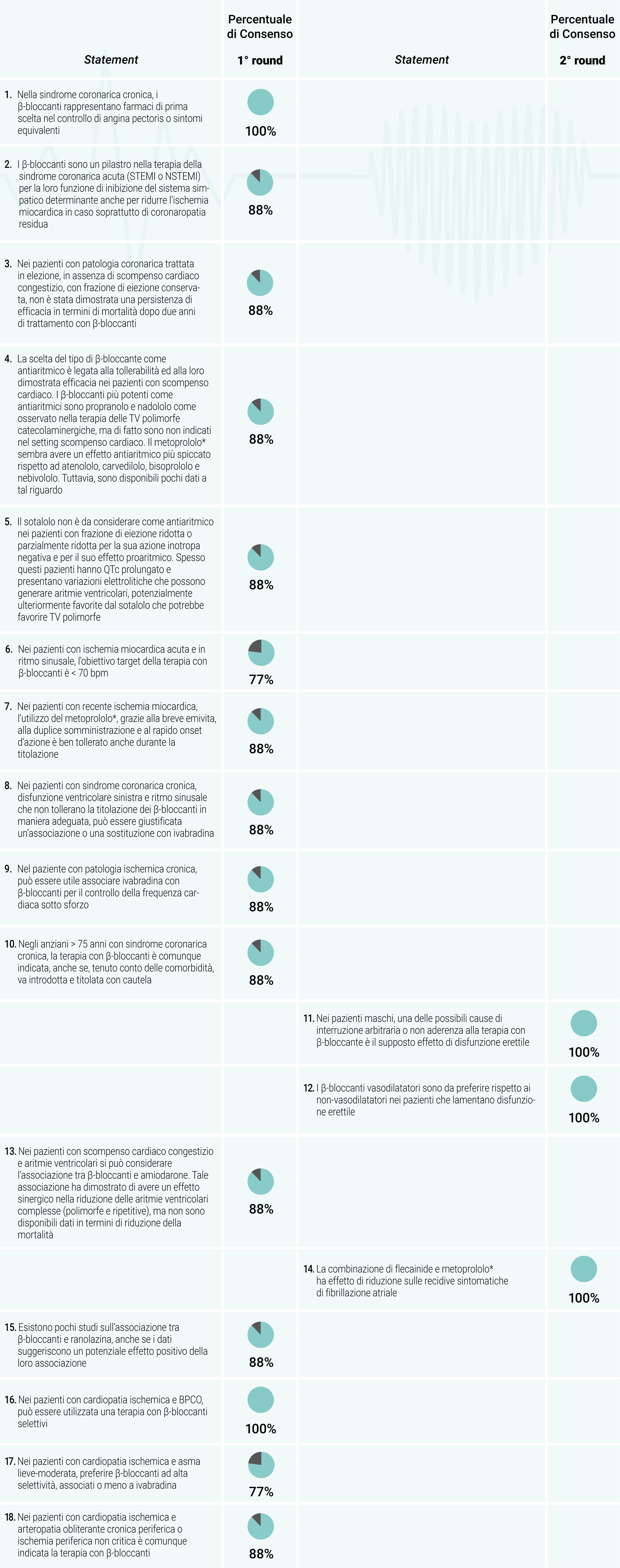 *In Italia è disponibile solo il metoprololo tartarato.
*In Italia è disponibile solo il metoprololo tartarato.
3.1 Aspetti generali
Statement
- Nella sindrome coronarica cronica, i β-bloccanti rappresentano farmaci di prima scelta nel controllo di angina pectoris o sintomi equivalenti
- I β-bloccanti sono un pilastro nella terapia della sindrome coronarica acuta (STEMI o NSTEMI) per la loro funzione di inibizione del sistema simpatico determinante anche per ridurre l’ischemia miocardica in caso soprattutto di coronaropatia residua
- Nei pazienti con patologia coronarica trattata in elezione, in assenza di scompenso cardiaco congestizio, con frazione di eiezione conservata, non è stata dimostrata una persistenza di efficacia in termini di mortalità dopo due anni di trattamento con β-bloccanti
- La scelta del tipo di β-bloccante come antiaritmico è legata alla tollerabilità ed alla loro dimostrata efficacia nei pazienti con scompenso cardiaco. I β-bloccanti più potenti come antiaritmici sono propranolo e nadololo come osservato nella terapia delle TV polimorfe catecolaminergiche, ma di fatto sono non indicati nel setting scompenso cardiaco. Il metoprololo* sembra avere un effetto antiaritmico più spiccato rispetto ad atenololo, carvedilolo, bisoprololo e nebivololo. Tuttavia, sono disponibili pochi dati a tal riguardo
- Il sotalolo non è da considerare come antiaritmico nei pazienti con frazione di eiezione ridotta o parzialmente ridotta per la sua azione inotropa negativa e per il suo effetto proaritmico. Spesso questi pazienti hanno QTc prolungato e presentano variazioni elettrolitiche che possono generare aritmie ventricolari, potenzialmente ulteriormente favorite dal sotalolo che potrebbe favorire TV polimorfe
*In Italia è disponibile solo il metoprololo tartarato.
I β-bloccanti rappresentano un pilastro della terapia anti-ischemica nei pazienti con coronaropatia cronica stabile, soprattutto nei casi di pregresso o recente infarto miocardico.7 I β-bloccanti svolgono il loro ruolo anti-anginoso riducendo la frequenza cardiaca, il post-carico e la contrattilità e producendo, in definitiva, una riduzione della richiesta miocardica di ossigeno.7 Essi aumentano, inoltre, il riempimento diastolico e la perfusione coronarica, migliorando anche il supporto miocardico di ossigeno.7 Per tali meccanismi farmacologici, i β-bloccanti sono in grado di ridurre la frequenza degli episodi di angina e di aumentare il limite di tolleranza allo sforzo per la comparsa della stessa.7 Ad esempio, nello studio TIBBS la somministrazione di bisoprololo – 10 mg al giorno – si è rivelata più efficace della nifedipina – 20 mg due volte al giorno – nel ridurre il numero e la durata degli episodi ischemici transitori nei pazienti con angina stabile cronica.8 In maniera similare, lo studio IMAGE ha dimostrato la maggiore efficacia del metoprololo – 200 mg al giorno – rispetto alla nifedipina – 20 mg due volte al giorno – nell’aumentare la tolleranza allo sforzo fisico (in termini di tempo di esercizio fisico necessario a produrre 1 mm di sottoslivellamento del tratto ST) nei pazienti con angina stabile.9
Sono numerosi gli studi randomizzati che, nell’era pre-angioplastica primaria sistematica, hanno dimostrato l’efficacia dei β-bloccanti nel ridurre la mortalità dei pazienti con infarto miocardico sia nel breve che nel lungo periodo.10 Studi più recenti hanno confermato tale efficacia anche nei pazienti che hanno ricevuto una rivascolarizzazione percutanea.11-13 In particolare, nei pazienti con infarto miocardico con elevazione del tratto ST (STEMI) la somministrazione endovenosa precoce di metoprololo, rispetto al placebo, si è dimostrata efficace nel ridurre l’estensione dell’area ischemica (25.6 ± 15.3 g versus 32.0 ± 22.2 g) e nell’aumentare la frazione di eiezione ventricolare sinistra (+ 2.7%) in assenza di un rischio aumentato di complicanze nelle 24 ore successive alla somministrazione del farmaco (evento composito comprendente il decesso, aritmie ventricolari maligne, shock cardiogeno, blocco atrio-ventricolare e re-infarto).11 Nessun paziente nel gruppo di trattamento è deceduto.11 L’efficacia del metoprololo nel ridurre l’estensione dell’area di ischemia è stata confermata anche da un recente studio su modelli murini di infarto miocardico.14 Riguardo alla durata della terapia con β-bloccanti in questo scenario clinico, i dati di una recente meta-analisi hanno dimostrato come il loro utilizzo sia in grado di ridurre il rischio di infarto ricorrente e di angina nel breve periodo (30 giorni dall’evento acuto) nei pazienti che hanno ricevuto la terapia massimale ad oggi a disposizione (compresa angioplastica primaria).15 Nel lungo periodo, invece, l’utilizzo di tale classe farmacologica deve essere ben valutato tenendo conto del rischio aumentato di scompenso cardiaco, shock cardiogeno, interruzione del farmaco.15 L’efficacia sulla mortalità per ogni causa sembrerebbe rimanere significativa sia durante primo (Hazard Ratio 0.81; intervalli di confidenza al 95%, 0.72 – 0.91) che il secondo anno (Hazard Ratio 0.86; intervalli di confidenza al 95%, 0.75 – 0.99), ma non dopo il terzo anno (Hazard Ratio 0.87; intervalli di confidenza al 95%, 0.73 – 1.03) dall’infarto miocardico acuto e dall’inizio della terapia con β-bloccante.4,16
In determinati scenari clinici, i β-bloccanti possono essere utilizzati anche per le loro capacità antiaritmiche. L’attività β-adrenergica, infatti, influenza significativamente anche l’elettrofisiologia cardiaca e contribuisce allo sviluppo di aritmie potenzialmente fatali, soprattutto nei pazienti con anomalie strutturali del miocardio quali la dilatazione, la fibrosi, l’ipertrofia e l’ischemia.3 Per tale motivo, l’uso dei β-bloccanti è stato associato ad una riduzione dell’effetto pro-aritmico derivante da una alterata attività β-adrenergica con meccanismi diversi a seconda del tipo di aritmia instauratasi.3 In particolare, l’aggiunta del metoprololo alla terapia convenzionale è stata associata ad una riduzione delle aritmie maligne e della morte cardiaca improvvisa nei pazienti con infarto miocardico e scompenso cardiaco.17,18 In maniera similare, in un piccolo studio che ha incluso 34 pazienti con tachicardia ventricolare polimorfica catecolaminergica, il nadololo si è dimostrato efficace nel ridurre l’incidenza e la gravità delle aritmie ventricolari.19 Studi su modelli porcini di infarto miocardico avrebbero dimostrato anche l’efficacia del bisoprololo nel ridurre il rischio di aritmie ventricolari.20 Infine, il sotalolo è un farmaco con notevoli proprietà antiaritmiche che, in qualche modo, possono essere assimilate a quelle degli antiaritmici di I classe.21 Questo farmaco, infatti, ha dimostrato la capacità di ridurre l’ectopia ventricolare e di prevenire le recidive di tachicardia e fibrillazione ventricolare.21 Al contrario, nei pazienti con cardiopatia ischemica e disfunzione ventricolare sinistra l’utilizzo del sotalolo non è da considerare in quanto è stato associato ad un rischio aumentato di morte presumibilmente per cause aritmiche rispetto al placebo (5% vs 3%).22 Le aritmie principalmente associate alla somministrazione di sotalolo sono le bradiaritmie e le tachicardie ventricolari polimorfe.22
4. Titolazione del farmaco, raggiungimento del target terapeutico e aderenza terapeutica
Statement
6. Nei pazienti con ischemia miocardica acuta e in ritmo sinusale, l’obiettivo target della terapia con β-bloccanti è < 70 bpm
7. Nei pazienti con recente ischemia miocardica, l’utilizzo del metoprololo*, grazie alla breve emivita, alla duplice somministrazione e al rapido onset d’azione è ben tollerato anche durante la titolazione
8. Nei pazienti con sindrome coronarica cronica, disfunzione ventricolare sinistra e ritmo sinusale che non tollerano la titolazione dei β-bloccanti in maniera adeguata, può essere giustificata un’associazione o una sostituzione con ivabradina
9. Nel paziente con patologia ischemica cronica, può essere utile associare ivabradina con β-bloccanti per il controllo della frequenza cardiaca sotto sforzo
10. Negli anziani > 75 anni con sindrome coronarica cronica, la terapia con β-bloccanti è comunque indicata, anche se, tenuto conto delle comorbidità, va introdotta e titolata con cautela
11. Nei pazienti maschi, una delle possibili cause di interruzione arbitraria o non aderenza alla terapia con β-bloccante è il supposto effetto di disfunzione erettile
12. I β-bloccanti vasodilatatori sono da preferire rispetto ai non-vasodilatatori nei pazienti che lamentano disfunzione erettile
*In Italia è disponibile solo il metoprololo tartarato.
Tra i fattori clinici da valutare durante la titolazione della terapia con β-bloccanti, la frequenza cardiaca ne rappresenta il principale in quanto, nei pazienti con cardiopatia ischemica, risulta associata in modo direttamente proporzionale ad una più alta prevalenza e gravità di angina, ad una più alta prevalenza di ischemia miocardica e ad un peggiore stato di salute.23 La maggior parte dei dati ad oggi a disposizione riguardanti il target terapeutico da raggiungere durante la titolazione della terapia con β-bloccanti deriva dagli studi disponibili sulla gestione dei pazienti con scompenso cardiaco.23-25 In tale scenario clinico, il limite di 70 battiti per minuto sembrerebbe essere il più utile in termini di efficacia terapeutica.23-25 I pazienti con una frequenza cardiaca durante terapia con β-bloccante < 70 battiti per minuto, infatti, sembrerebbero presentare un minor rischio di mortalità rispetto ai pazienti con dei valori di frequenza cardiaca > 70 battiti per minuto.25 Inoltre, la riduzione della frequenza cardiaca, e non il dosaggio totale di β-bloccante somministrato sembrerebbe essere associato in modo direttamente proporzionale alla riduzione della mortalità.26 L’aggiunta dell’ivabradina, soprattutto nei pazienti con difficoltà a raggiungere i target terapeutici di frequenza cardiaca, può rappresentare una valida scelta terapeutica. Nei pazienti con cardiopatia ischemica, infatti, l’aggiunta di tale farmaco al β-bloccante, rispetto al placebo, si è dimostrata efficace nel ridurre in maniera significativa la frequenza cardiaca sia basale (- 6.9 vs - 1.1 battiti al minuto) che durante esercizio fisico (- 8.9 vs - 0.1 battiti al minuto).27 Tale associazione terapeutica si è dimostrata utile anche nell’aumentare la durata totale dell’esercizio fisico, il tempo necessario per l’insorgenza di angina e per lo sviluppo di 1 mm di sottoslivellamento del tratto ST durante sforzo fisico.27
Durante il processo di scelta e titolazione dei β-bloccanti si dovrebbe tener conto delle caratteristiche individuali del paziente (ad esempio la presenza di comorbidità) e delle caratteristiche farmacologiche della molecola utilizzata (ad esempio l’emivita, la rapidità d’azione, il numero di somministrazioni giornaliere necessarie, la cardio-selettività) in quanto tali fattori potrebbero alterare l’efficacia della terapia somministrata o ridurre l’aderenza al trattamento farmacologico proposto.28 Anche l’età del paziente deve essere tenuta in considerazione. Una minor percentuale di pazienti anziani (31%), infatti, è stata in grado di raggiungere il target terapeutico rispetto ai pazienti più giovani (tra il 42 e l’87%).28 Infine, il supposto effetto dei β-bloccanti sulla funzione erettile potrebbe essere un altro fattore potenzialmente associato ad una ridotta aderenza alla terapia. Tale situazione clinica ha una elevata prevalenza nella popolazione generale, soprattutto nei pazienti con età avanzata e comorbidità cardiovascolari, ed è in grado di influenzare negativamente la qualità di vita.29 Una recente meta-analisi, comunque, ha dimostrato come l’utilizzo dei β-bloccanti vasodilatatori (Odds Ratio, 2.07; intervalli di confidenza al 95%, 0.6 – 7.1) e non vasodilatatori (Odds Ratio, 0.96; intervalli di confidenza al 95%, 0.33 – 2.82) non sia associato ad un’aumentata probabilità di sviluppare disfunzione erettile.29 Seppur con i limiti intrinseci al disegno dello studio, il nebivololo sembrerebbe avere il minor effetto sulla probabilità di sviluppare disfunzione erettile, seguito dagli altri β-bloccanti vasodilatatori.29 L’uso dei β-bloccanti vasodilatatori dovrebbe, pertanto, essere considerato nei pazienti che lamentano disfunzione erettile.
5. Associazione dei ß-bloccanti con altri farmaci antiaritmici o antianginosi
Statement
13. Nei pazienti con scompenso cardiaco congestizio e aritmie ventricolari si può considerare l'associazione tra β-bloccanti e amiodarone. Tale associazione ha dimostrato di avere un effetto sinergico nella riduzione delle aritmie ventricolari complesse (polimorfe e ripetitive), ma non sono disponibili dati in termini di riduzione della mortalità
14. La combinazione di flecainide e metoprololo* ha effetto di riduzione sulle recidive sintomatiche di fibrillazione atriale
15. Esistono pochi studi sull’associazione tra β-bloccanti e ranolazina, anche se i dati suggeriscono un potenziale effetto positivo della loro associazione
*In Italia è disponibile solo il metoprololo tartarato.
L’associazione del β-bloccante con altri farmaci antiaritmici o antianginosi può risultare utile nella gestione dei pazienti con particolari situazioni cliniche come, ad esempio, nei casi di aritmie ventricolari complesse o di fibrillazione atriale e di persistenza di angina nonostante la terapia medica instaurata. In particolare, l’amiodarone rappresenta un agente antiaritmico con delle proprietà complesse tra cui anche un possibile effetto anti-adrenergico.30 Nonostante tale associazione debba essere valutata e utilizzata con cautela, i risultati a disposizione hanno dimostrato la sua efficacia nel ridurre la mortalità per cause aritmiche nei pazienti con cardiopatia ischemica (Relative Risk, 0.68; intervalli di confidenza al 95%, 0.48 – 0.95).30 I dati di un altro studio randomizzato controllato hanno confermato l’efficacia di tale associazione, rispetto al solo β-bloccante, anche nella prevenzione delle scariche del defibrillatore cardiaco impiantabile nei pazienti in profilassi secondaria delle aritmie ventricolari maligne (Hazard ratio, 0.27; intervalli di confidenza al 95%, 0.14 - 0.52).31
Nella fibrillazione atriale, ed in particolare nei pazienti con una scarsa risposta alla monoterapia somministrata, può essere valutata l’aggiunta della flecainide al β-bloccante.32 L’associazione di tale farmaco al metoprololo, infatti, si è dimostrata più efficace rispetto alla monoterapia nel migliorare il controllo del ritmo, nel ridurre le recidive sintomatiche di fibrillazione atriale e nel migliorare la tollerabilità e l’aderenza terapeutica anche grazie ad una riduzione degli effetti collaterali e ad un miglioramento della qualità di vita.32
Infine, la co-somministrazione di ranolazina può essere
valutata nei pazienti con cardiopatia ischemica che rimangono ancora sintomatici nonostante la terapia massimale anti-ischemica instaurata.33 L’utilizzo della ranolazina in una popolazione in cui la pressoché totalità dei pazienti già assumeva β-bloccante, infatti, si è associato ad una riduzione delle recidive ischemiche (Hazard Ratio, 0.78; intervalli di confidenza al 95%, 0.67 - 0.91), o di angina (Hazard Ratio, 0.77; intervalli di confidenza al 95%, 0.59 - 1.00) e ad un aumento della durata di esercizio fisico (514 s vs 482 s), in assenza di un effetto benefico sulla mortalità per causa cardiovascolare (Hazard Ratio, 0.97; intervalli di confidenza al 95%, 0.80 - 1.16).33
6. Utilizzo dei ß-bloccanti nei pazienti con altre comorbidità
Statement
16. Nei pazienti con cardiopatia ischemica e BPCO, può essere utilizzata una terapia con β-bloccanti selettivi
17. Nei pazienti con cardiopatia ischemica e asma lieve-moderata, preferire β-bloccanti ad alta selettività, associati o meno a ivabradina
18. Nei pazienti con cardiopatia ischemica e arteropatia obliterante cronica periferica o ischemia periferica non critica è comunque indicata la terapia con β-bloccanti
La concomitante presenza di malattie cardiovascolari e polmonari, quali la broncopneumopatia cronica ostruttiva (BPCO) e l’asma, è molto frequente nella popolazione generale e rende la gestione clinica molto difficoltosa per le possibili interazioni con i farmaci necessari. I differenti recettori β-adrenergici, però, hanno una variabile distribuzione all’interno degli organi con una maggiore quantità di recettori β1 a livello cardiaco e di recettori β2 a livello polmonare.34 Per tale motivo, nella gestione terapeutica dei pazienti con cardiopatia ischemica e BPCO può essere considerato l’utilizzo dei β-bloccanti cardio-selettivi.35 Le evidenze ad oggi disponibili, anche se limitate, confermano tale concetto in quanto l’utilizzo dei β-bloccanti cardio-selettivi rispetto al placebo non sembrerebbe causare un peggioramento dei sintomi, della funzionalità respiratoria o della risposta al trattamento con β2-agonisti, ma sembrerebbe essere associato ad una riduzione della mortalità (28%) e del rischio di riacutizzazione (37%).36-40 In quest’ultimo caso, si potrebbe ipotizzare che l’utilizzo del β-bloccante sia efficace in quanto una parte degli eventi inquadrati come riacutizzazioni siano, invece, eventi cardiaci.34 Il dato sulla riduzione della mortalità nei pazienti con BPCO che hanno ricevuto β-bloccante è stato confermato, in particolar modo per il bisoprololo, anche da un recente studio osservazionale.41
Le evidenze a disposizione circa l’utilizzo dei β-bloccanti nei pazienti con asma sono ancora più limitate. Comunque, la somministrazione dei β-bloccanti cardio-selettivi in tale scenario clinico non sembrerebbe aumentare l’incidenza di riacutizzazione di asma.42,43 In considerazione dei possibili rischi associati alla terapia con β-bloccante nel paziente con BPCO e asma, soprattutto in quelli con una maggiore gravità della malattia polmonare, è opportuna una valutazione delle prove di funzionalità respiratoria per verificarne la risposta e la probabile tollerabilità.
I pazienti con arteriopatia obliterante periferica cronica hanno un rischio aumentato di malattia cardiovascolare in generale e di cardiopatia ischemica in particolare.44 Inoltre, circa il 5% di questi pazienti muore per un infarto miocardico acuto.44 Anche in questo scenario clinico le evidenze a disposizione sono molto limitate, ma l’utilizzo dei β-bloccanti sembrerebbe ridurre il rischio di recidiva di infarto miocardico (53%) senza
alterare il flusso arterioso e le resistenze vascolari distali e la distanza di camminata.45,46 Nonostante ciò, l’utilizzo di tali farmaci nei pazienti con ischemia critica dell’arto deve essere valutato con estrema cautela.
7. Conclusioni
I β-bloccanti rappresentano un pilastro della terapia farmacologica dei pazienti con cardiopatia ischemica per le loro capacità di prevenire e trattare gli eventi anginosi e ischemici ricorrenti e le aritmie associate. La presenza di comorbidità rende la gestione clinica di questi pazienti difficoltosa e, a volte, rende necessaria l’associazione di terapie aggiuntive in grado di aumentarne l’efficacia e la sicurezza.
Le indicazioni cliniche riportate all’interno di questo documento sono in grado di fornire uno strumento molto utile per la gestione quotidiana del paziente che, per la presenza di patologia cardiovascolare, necessità della terapia con β-bloccanti per la prevenzione e il trattamento dell’angina, dell’infarto miocardico e delle aritmie.
Gli autori ringraziano tutti i membri del Comitato Scientifico per la loro partecipazione e il loro contribuito al metodo Delphi applicato in questa pubblicazione.
Il Comitato Scientifico è composto da:
Alessandro Capucci
Professore Ordinario in Cardiologia Università Politecnica delle Marche, Ancona | Direttore SOD Clinica di Cardiologia e Aritmologia Ospedali Riuniti, Ancona
Francesco Giallauria
Professore Associato di Medicina Interna, Dipartimento di Scienze Mediche Traslazionali, Università di Napoli Federico II
Luigi Di Lorenzo
Direttore UOC Cardiologia e UTIC Ospedale Civile di Sessa Aurunca (CE)
Gerardo Mancuso
Direttore SOC Medicina Interna Ospedale Giovanni Paolo II, Lamezia Terme (CZ) | Direttore UOC Medicina Interna-Lungodegenza Ospedale di Soveria (CZ) | Vice Presidente Nazionale SIMI (Società Italiana di Medicina Interna)
Marco Marini
Dirigente Medico SOD Cardiologia Ospedaliera e UTIC; Responsabile SOS Terapia Intensiva Cardiologica, AOU Ospedali Riuniti di Ancona | Chairperson Area Scompenso Cardiaco ANMCO (Associazione Nazionale Medici Cardiologi Ospedalieri)
Alberto Milan
Professore Associato di Medicina Interna, Università di Torino
Daniele Nassiacos
Direttore UOC Cardiologia - UTIC Ospedale di Saronno - ASST Valle Olona (VA)
Massimo Francesco Piepoli
Direttore UOC Cardiologia Clinica, Policlinico S. Donato IRCCS, Università degli Studi di Milano | Vice presidente ESC (European Society of Cardiology)
Pasquale Predotti
Responsabile Centro Ipertensione Arteriosa AOU San Giovanni di Dio e Ruggi D’Aragona, Salerno
Per il supporto all’applicazione del metodo e all’attività di medical writing si ringraziano rispettivamente la Dr.ssa Ludovica Cimini, MD, Medicina Vascolare d’Urgenza, Stroke Unit, Ospedale Santa Maria della Misericordia, Università degli studi di Perugia e
il Dr. Emanuele Valeriani, MD, Medicina Interna UO Malattie Infettive, Azienda Ospedaliera Universitaria, Policlinico Umberto I, Roma
Si ringrazia Recordati S.p.A. per il contributo incondizionato


Lascia un commento