1. Generalità
Lo pneumococco (Streptococcus pneumoniae) è un batterio molto diffuso che ha come ospite obbligato l’uomo e si trova comunemente nel tratto respiratorio superiore di bambini e adulti sani. Può determinare quadri patologici di diversa gravità che variano da sinusiti e otiti medie fino ad infezioni severe quali polmoniti, meningiti e sepsi, specialmente nei lattanti fino all’anno di età, negli anziani e nei soggetti affetti da varie patologie.1
I vaccini, ad oggi, in uso sono tutti diretti contro ceppi capsulati di S. pneumoniae. I ceppi si distinguono fra loro in sierotipi, sulla base dei polisaccaridi presenti sulla capsula.
2. Epidemiologia, copertura vaccinale e selezione dei sierotipi
Epidemiologia
L’incidenza della malattia pneumococcica invasiva (Invasive Pneumococcal Disease, IPD) in qualsiasi popolazione è influenzata da diversi fattori: posizione geografica, periodo dell’anno, prevalenza del sierotipo, età, comorbidità e stato vaccinale. In Europa, secondo il Surveillance Report dell’European Center for Disease Prevention and Control (ECDC), nel 2018, sono stati segnalati 24.663 casi confermati di malattia invasiva da pneumococco da 29 Paesi. Il tasso di notifica è stato di 6,2 casi per 100.000 abitanti. In particolare, il Regno Unito ha riportato il numero più alto di casi confermati, seguito dalla Francia.2 Sempre nel 2018, l’IPD è stata segnalata prevalentemente negli anziani e nei bambini di età inferiore ad un anno, con 18,7 casi confermati ogni 100.000 abitanti negli adulti di età pari o superiore a 65 anni, e 14,4 casi confermati ogni 100.000 abitanti nei bambini di età inferiore a un anno. I tassi di malattia sono rimasti, invece, più bassi nelle persone di età compresa tra 5 e 24 anni (0,8 casi confermati per 100.000 abitanti). L’incidenza è stata più alta nel sesso maschile in tutte le fasce di età con un rapporto complessivo maschio-femmina pari a 1,2:1.
La distribuzione stagionale dei casi di IPD ha seguito un modello simile a quello di molte altre malattie respiratorie. I casi sono stati in numero minore durante l’estate; si è assistito, poi, ad un aumento rapido all’inizio dell’autunno e al raggiungimento del picco durante i mesi invernali.3
A livello nazionale, dall’ultimo rapporto dell’Istituto Superiore di Sanità sulle Malattie Batteriche Invasive, pubblicato nel novembre 2021 e relativo al periodo 2018-2020, nel 2020 sono stati segnalati 499 casi di IPD da pneumococco. Nel 2019, erano stati segnalati 1679 casi e, nel 2018, 1547.
La diminuzione delle segnalazioni che si è osservata nel 2020, con ogni probabilità, è dovuta sia ai provvedimenti messi in atto per l’emergenza da COVID-19 (distanziamento sociale e utilizzo dei dispositivi di protezione individuale), che ad una sotto notifica dovuta al sovraccarico delle strutture sanitarie nel periodo pandemico (Figura 1).4
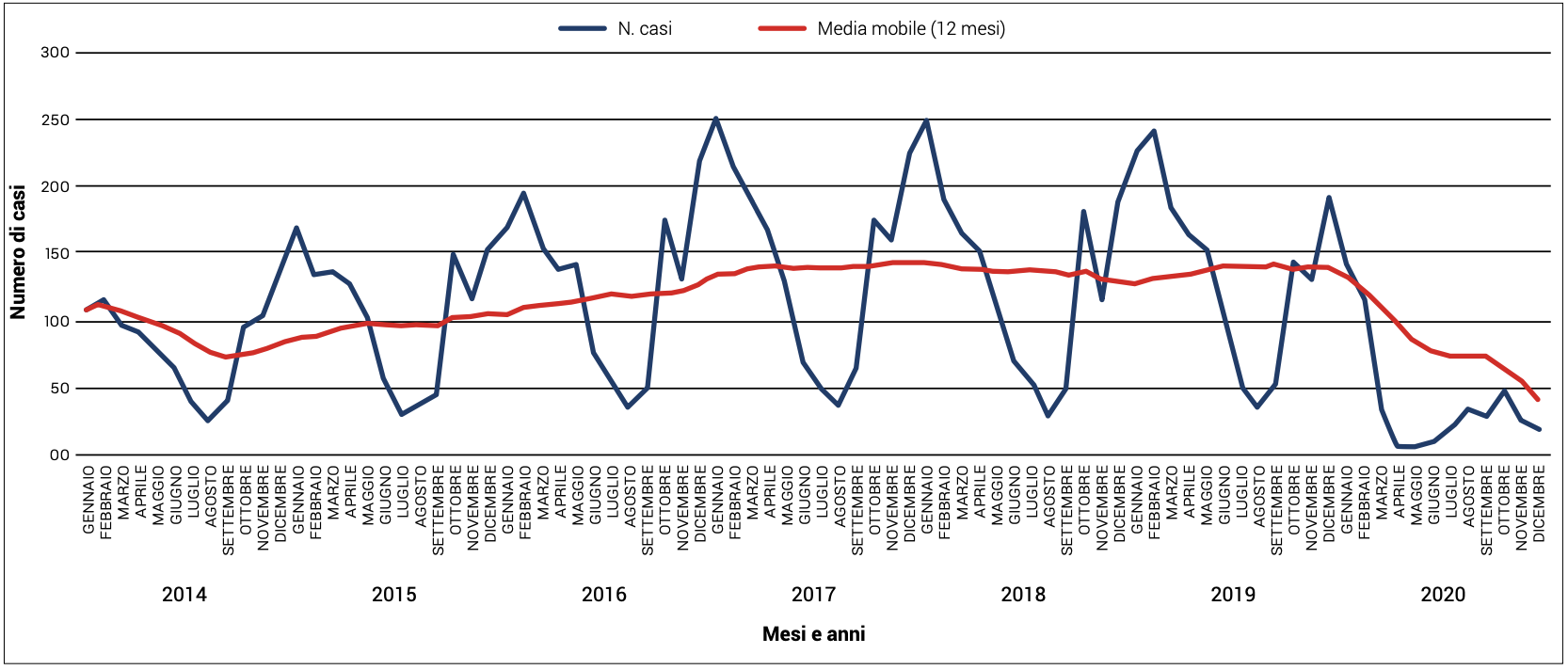 Figura 1. Numero di casi notificati di malattia invasiva da pneumococco, per mese ed anno, Italia 2014-2020.4
Figura 1. Numero di casi notificati di malattia invasiva da pneumococco, per mese ed anno, Italia 2014-2020.4
Nel complesso, le malattie invasive da pneumococco in Italia nel periodo di riferimento hanno avuto un’incidenza compresa tra 0,84/100.000 abitanti nel 2020, 2,81/100.000 abitanti nel 2019 e 2,56/100.000 nel 2018.4
Rimanendo sempre in Italia, nel 2019 l’incidenza della malattia invasiva da pneumococco per 100.000 abitanti è risultata maggiore nei bambini di età <1 anno (2,65) in diminuzione rispetto al biennio precedente 5,04 nel 2018 e 6,50 nel 2019, e negli adulti >64 anni (2,04), anch’essa in diminuzione rispetto al 2019 (7,36) e al 2018 (6,67). Nello stesso periodo anche l’incidenza nella classe di età 25-64 anni si è più che dimezzata (da 1,73 nel 2019 a 0,54 nel 2020), (Tabella 1).4
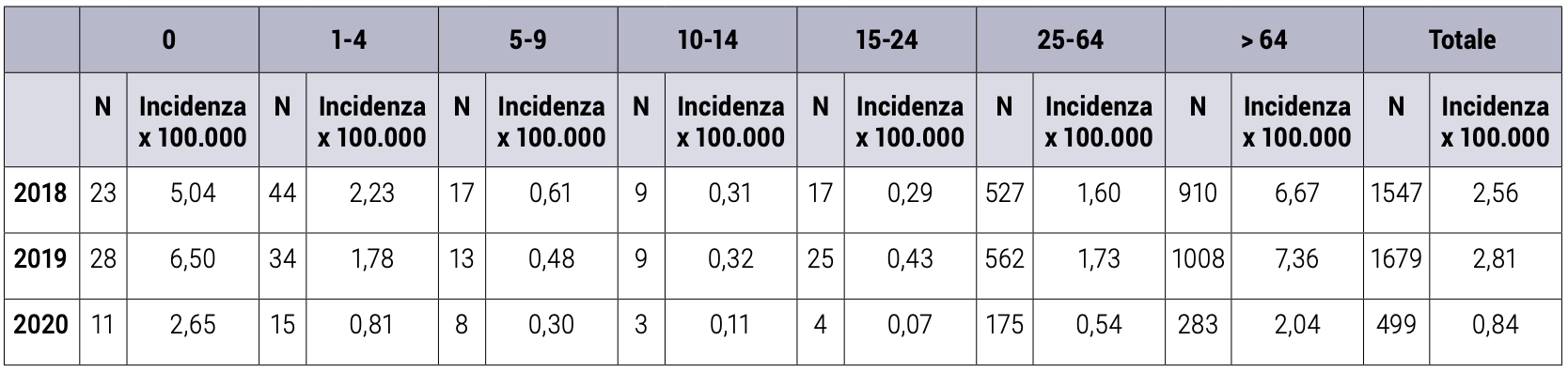 Tabella 1. Casi e incidenza da malattia invasiva da pneumococco per età e anno (2018-2020).4
Tabella 1. Casi e incidenza da malattia invasiva da pneumococco per età e anno (2018-2020).4
Nel periodo 2018-2020, il quadro clinico più frequente è stato rappresentato da sepsi/batteriemia (tra il 37% e il 39% dei casi) e dalla polmonite associata a sepsi/batteriemia (tra il 33% e il 36%), seguite dalla meningite associata o meno a sepsi/batteriemia (tra il 23% e il 26%), (Tabella 2). Quadri clinici di polmonite, pleurite e peritonite, con isolamento da siti sterili diversi dal sangue, sono stati rari.4
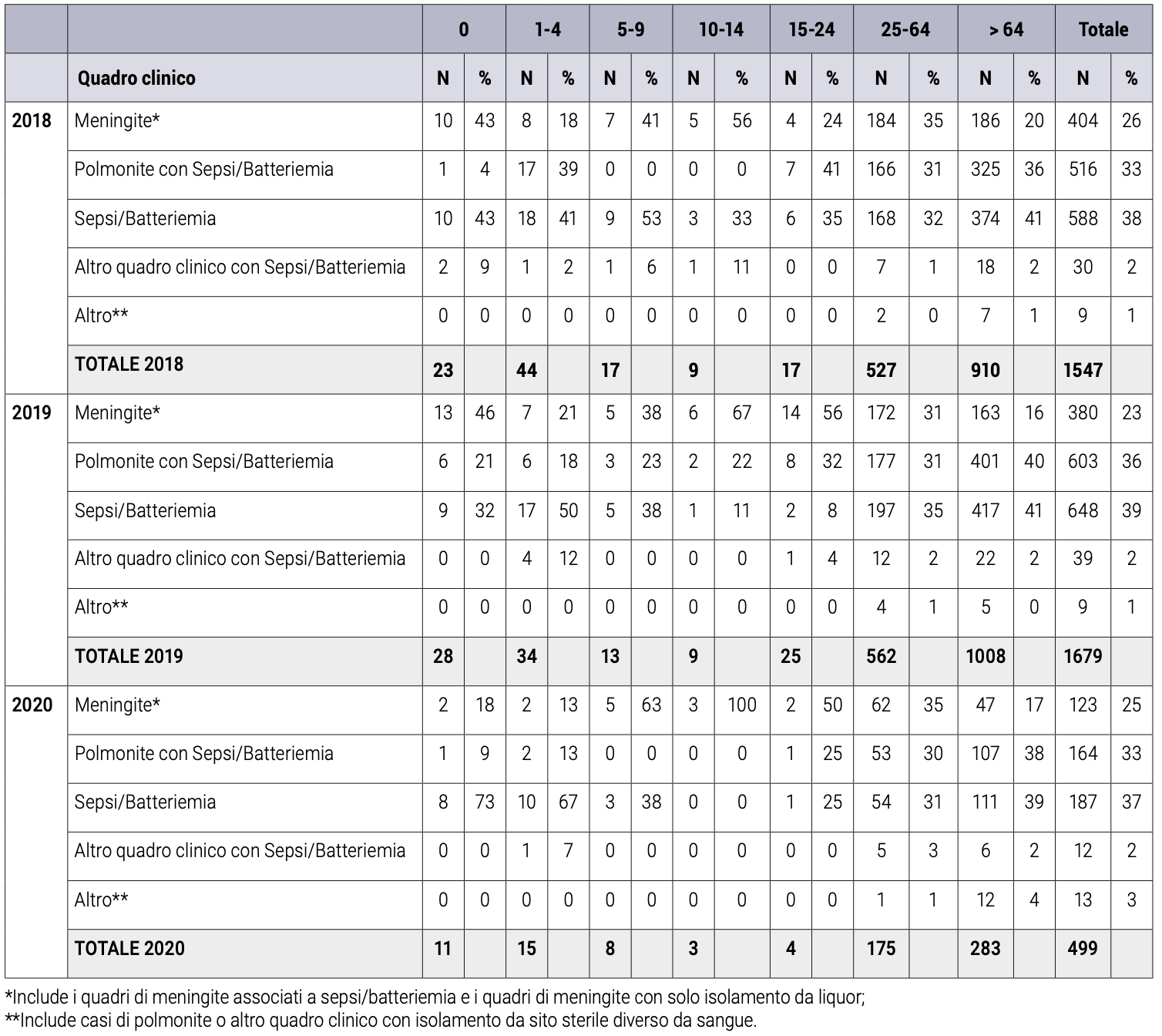 Tabella 2. Casi di malattia invasiva da pneumococco per quadro clinico, età e anno (2018-2020).4
Tabella 2. Casi di malattia invasiva da pneumococco per quadro clinico, età e anno (2018-2020).4
Impatto epidemiologico della vaccinazione pediatrica
L’incidenza complessiva della IPD negli Stati Uniti è diminuita a partire dall’anno 2000, in seguito all’introduzione e all’uso diffuso nei bambini del vaccino pneumococcico coniugato 7-valente (PCV7). La ridotta incidenza è stata determinata sia dalla diminuzione dell’IPD nella popolazione pediatrica vaccinata che dalla riduzione nella popolazione adulta, presumibilmente a causa degli effetti indiretti dell’immunità di gregge sulla trasmissione dello pneumococco.
A seguito dell’introduzione del PCV7, sono state osservate riduzioni dei ricoveri per meningite e polmonite pneumococcica, sia nei bambini che negli adulti. Tuttavia, è importante segnalare che è stato osservato simultaneamente un aumento dei casi di infezione e colonizzazione nasofaringea da parte di S. pneumoniae, imputabili a sierotipi non inclusi nel vaccino PCV7: i cosiddetti “ceppi sostitutivi”. Una diminuzione delle IPD si è registrata anche in Europa, ma i tempi e l’entità di questi cambiamenti variano nei diversi Paesi a causa delle differenze nelle politiche di immunizzazione e nel diffondersi dell’immunità di gregge.
Nel 2010, è stato introdotto il vaccino coniugato 13-valente (PCV13) per uso universale nei bambini, comprendente i sierotipi già presenti nel PCV7 più 6 sierotipi addizionali (1, 3, 5, 6A, 7F e 19A).
L’introduzione del PCV13 ha portato ad una diminuzione del 93% dei casi di IPD fra i bambini <5 anni fra il 1998 e il 2018 e ha influenzato sostanzialmente l’incidenza di IPD nella popolazione non vaccinata attraverso il fenomeno dell’immunità di gregge.
Nonostante la diminuzione complessiva della malattia pneumococcica (Pneumococcal Disease, PD) dopo il diffuso utilizzo dei PCV, ne persiste una sostanziale quota nell’era post-PCV attribuibile a sierotipi non inclusi nei vaccini coniugati. Questo dato evidenzia la necessità di espandere ulteriormente la copertura data dai vaccini per ampliare la protezione contro la malattia pneumococcica.
Il peso globale della PD resta considerevole con stimati 44.7 milioni di casi di infezione pneumococcica del tratto respiratorio inferiore e associate 341.029 morti nei bambini <5 anni nell’anno 2016.3
Al fine di estendere la copertura vaccinale, sono in elaborazione dei nuovi PCV contenenti sierotipi addizionali come, ad esempio, un PCV 20-valente contenente i componenti di PCV-13 e 7 sierotipi addizionali (8, 10A, 11A, 12F, 15B, 22F, 33F).
I sierotipi aggiuntivi sono stati selezionati sulla base di svariati fattori: l’associazione con l’aumentata severità della malattia, il potenziale invasivo del batterio, la resistenza antibiotica e la prevalenza, quale causa di PD pediatrica nell’era post-PCV.
Una metanalisi ha evidenziato che questi 7 sierotipi sono tra le cause prevalenti di IPD pediatriche nelle nazioni con programmi di vaccinazione con PCV in atto: 22F (5,3% dei casi), 12F (4,3%), 33F (4,5%), 15B (3,7%), 10A (3,4%), 8 (2,2%), 11A (2,0%).
Dati di sorveglianza del Center for Disease Control and Prevention hanno registrato che nel 2018 questi 7 sierotipi da soli sono stati responsabili negli USA per circa il 37% delle IPD nei bambini minori di 5 anni.5
Importanza del sierotipo
Il rischio di malattia invasiva sembra essere strettamente correlato al sierotipo. L’entità del rischio è definibile studiando i sierotipi isolati in pazienti con malattia invasiva e i sierotipi isolati a livello nasale o del rinofaringe in bambini asintomatici.
Alcuni sierotipi hanno probabilità fino a 60 volte maggiore di essere trovati in pazienti con malattia invasiva, rispetto ad altri sierotipi comunemente isolati in individui asintomatici. Inoltre, c’è una significativa correlazione inversa tra malattia invasiva e presenza dello pneumococco nel nasofaringe: i sierotipi più comunemente isolati nei pazienti con malattia invasiva sono i sierotipi meno comunemente isolati nei portatori asintomatici, e viceversa. Il sierotipo può anche essere un importante fattore determinante di severità della meningite pneumococcica. In uno studio condotto in Danimarca su pazienti con meningite pneumococcica, il sierotipo 1 era associato ad un tasso di mortalità per caso molto più basso rispetto al sierotipo 3 (3 contro 23%).3
La complessità della relazione tra sierotipo e rischio di malattia invasiva è qui riassunta:3
- All’interno di sierotipi invasivi possono esistere cloni invasivi e non invasivi.
- I componenti della parete cellulare e le strutture simili ai pili in alcuni ceppi di pneumococco si correlano con una maggior probabilità di causare malattie invasive.
- I polisaccaridi capsulari, che determinano il sierotipo, possono ostacolare l’attivazione del complemento e/o la fagocitosi e, quindi, favorire l’invasione dei tessuti e la batteriemia; dopodiché, altri fattori di virulenza pneumococcica possono essere responsabili dell’outcome dopo che la batteriemia è avvenuta.
Nel 2020, i sierotipi 8, 3, 15B/C, 15A, 9N, 19A, 18A, 14, 12F e 6C risultano i più rappresentati tra i ceppi tipizzati. Di questi solo il sierotipo 14 è compreso nel vaccino glicoconiugato 10-valente (PCV10 - 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F), mentre i sierotipi 3, 14 e 19A sono compresi nel vaccino 13-valente (PCV13 - 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F). Tutti i sierotipi maggiormente riscontrati, ad eccezione del 6C, 15A, 18A, sono presenti nel vaccino polisaccaridico 23-valente (PPSV23), (Tabella 3)4
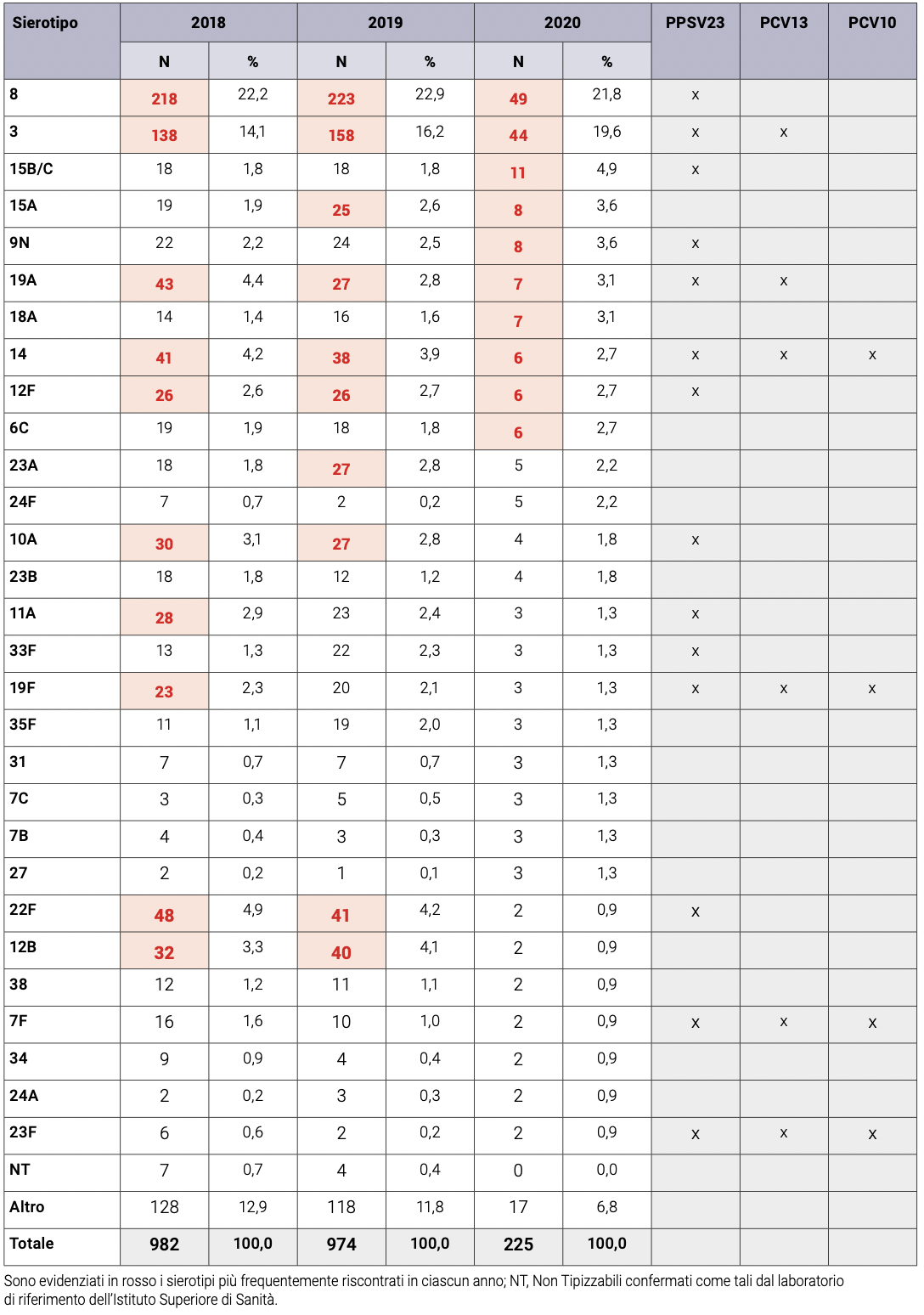 Tabella 3. Numerosità, assoluta e percentuale, in ordine decrescente sui dati 2020, per sierotipo e per anno dei ceppi di pneumococco isolati da infezioni invasive e inviati all’ISS e/o tipizzati da altro laboratorio (2018-2020).4
Tabella 3. Numerosità, assoluta e percentuale, in ordine decrescente sui dati 2020, per sierotipo e per anno dei ceppi di pneumococco isolati da infezioni invasive e inviati all’ISS e/o tipizzati da altro laboratorio (2018-2020).4
3. Aspetti microbiologici e immunologici
Lo Streptococcus pneumoniae è un cocco Gram positivo capsulato, extracellulare, alfa emolitico e anaerobio facoltativo, che si dispone tipicamente in coppie (da cui il nome di diplococco) o in brevi catene (Figura 2).
 Figura 2. Streptococcus pneumoniae.
Figura 2. Streptococcus pneumoniae.
Lo pneumococco occupa una posizione rilevante nella storia della microbiologia.
Venne identificato per la prima volta nel 1881 da Pasteur e da Sternberg in modo indipendente.
Fu Griffith che, nel 1928, durante esperimenti finalizzati alla ricerca di una cura per la polmonite causata da S. pneumoniae, dimostrò la capacità dei batteri di trasferire informazioni genetiche fra di loro andando a mutare, grazie a questi passaggi, la loro stessa composizione. Griffith scoprì, quindi, che questi microrganismi erano “mutabili” ed iniziò a ipotizzare quale fosse l’agente responsabile che denominò “principio trasformante”, pensando erroneamente che si trattasse di una sostanza di natura proteica.
Nel 1943, Avery, MacLeod e McCarty dimostrarono che si trattava di materiale genetico. Tuttavia, la conferma arrivò solo nel 1953, quando Watson e Crick riuscirono ad identificare la struttura molecolare del “principio trasformante” corrispondente al DNA.
Lo pneumococco ha caratteristiche genomiche che lo rendono paradigmatico per ricombinazione e plasticità genetica.
Sono attualmente riconosciuti più di 90 sierotipi, raggruppati in almeno 40 sottogruppi, importantissimi per valutare i tipi di pneumococco epidemiologicamente più coinvolti nelle diverse patologie e prevalenti nelle diverse aree geografiche.
S. pneumoniae possiede una capsula polisaccaridica che lo rende resistente all’opsonizzazione e alla fagocitosi ed è considerata il principale fattore pneumococcico di patogenicità. La perdita della capsula si accompagna, infatti, alla perdita di virulenza. La parete cellulare è costituita da diversi strati di molecole di peptidoglicano, cui sono intercalate molecole di acido teicoico. La fosforilcolina è un elemento essenziale nella struttura di S. pneumoniae, essendo uno dei costituenti degli acidi teicoici e lipoteicoici, ed è uno dei principali determinanti della virulenza del batterio: la fosforilcolina ha un ruolo fondamentale nel processo di colonizzazione delle alte vie aeree, essendo riconosciuta da specifici recettori di membrana, presenti sulla maggior parte delle cellule umane. Un altro importante fattore di virulenza è rappresentato dai pili, presenti sulla superficie batterica e dotati di funzione adesiva. Sulla parete di S. pneumoniae sono, inoltre, presenti più di 500 proteine, alcune legate alla membrana plasmatica (lipoproteine), altre direttamente associate alla parete batterica. Una di queste, la pneumolisina (dPly), che appartiene al gruppo delle emolisine O (ossigeno-labili tiolo-attivate), interviene nella patogenicità dello pneumococco, grazie alla sua capacità di formare pori a livello delle membrane eucariotiche e di interferire con l’attivazione del complemento (Figura 3).6,8
 Figura 3. Fattori di virulenza pneumococcica.6
Figura 3. Fattori di virulenza pneumococcica.6
PspA e PspC, proteine pneumococciche di superficie A e C; Hyl, ialuronato liasi; PavA, adesione e virulenza pneumococcica A; Eno, enolasi; LytA, autolisina A; PsaA, Adesina di superficie pneumococcica A; PiaA, acquisizione di ferro pneumococcico A; PiuA, assorbimento di ferro pneumococcico A.
Patogenesi
La colonizzazione iniziale dell’orofaringe è mediata dal legame dei batteri alle cellule epiteliali per mezzo di adesine proteiche di superficie.
La successiva migrazione del batterio verso il tratto respiratorio inferiore può essere evitata se i batteri vengono inglobati dal muco e, poi, rimossi dalle vie aeree mediante l’azione delle cellule epiteliali ciliate. Le IgA secretorie intrappolano i microrganismi nel muco, legando i batteri alla mucina con la regione Fc dell’anticorpo. I batteri contrastano questo meccanismo con la produzione di proteasi, che agiscono sulle IgA secretorie, e di pneumolisina, la quale può distruggere i fagociti e le cellule epiteliali ciliate (Figura 4).
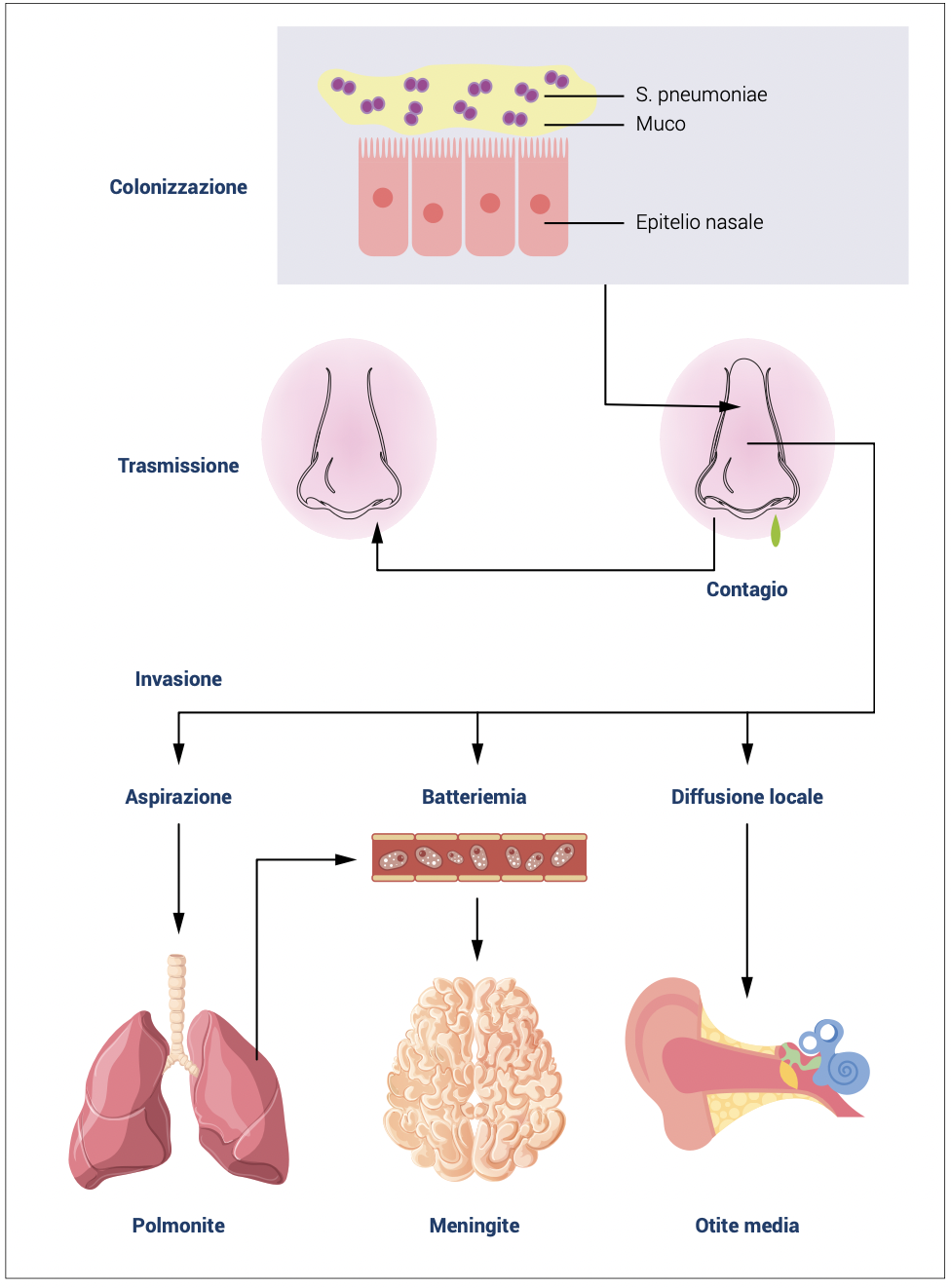 Figura 4. Il ciclo di vita dello Streptococcus pneumoniae e la patogenesi della malattia pneumococcica. Lo Streptococcus pneumoniae colonizza la mucosa del tratto respiratorio superiore, prerequisito sia per la trasmissione ad altri individui che per una malattia invasiva nel portatore. I portatori possono diffondere S. pneumoniae attraverso le secrezioni nasali. La disseminazione, oltre l’epitelio nasale, può portare a malattie invasive, come polmonite, meningite e otite media.
Figura 4. Il ciclo di vita dello Streptococcus pneumoniae e la patogenesi della malattia pneumococcica. Lo Streptococcus pneumoniae colonizza la mucosa del tratto respiratorio superiore, prerequisito sia per la trasmissione ad altri individui che per una malattia invasiva nel portatore. I portatori possono diffondere S. pneumoniae attraverso le secrezioni nasali. La disseminazione, oltre l’epitelio nasale, può portare a malattie invasive, come polmonite, meningite e otite media.
Figura elaborata da Weiser et al. Nat Rev Microbiol. 2018;16(6):355-367.
Una caratteristica delle infezioni pneumococciche è la mobilizzazione di cellule infiammatorie verso il focolaio di infezione, processo mediato da componenti propri del batterio, quali l’acido teicoico, il peptidoglicano e la pneumolisina. Infine, la fosforilcolina presente nella parete batterica può legarsi ai recettori per il Fattore Attivante Piastrinico espressi sulle cellule endoteliali, leucociti, piastrine e cellule di alcuni tessuti, come quello dei polmoni e delle meningi. I batteri possono entrare nelle cellule mediante il legame con questi recettori, meccanismo che li protegge dall’opsonizzazione e dalla fagocitosi, e raggiungere, così, aree protette, come il sangue e il SNC, facilitando la diffusione della malattia.
I ceppi capsulati possono provocare malattia nell’uomo, mentre i ceppi acapsulati sono normalmente avirulenti. La capsula di S. pneumoniae impedisce la fagocitosi e, grazie alla pneumolisina, il batterio sopravvive al burst ossidativo delle cellule fagocitiche. Gli anticorpi diretti contro i polisaccaridi capsulari tipo-specifici proteggono dalla malattia provocata da ceppi immunologicamente correlati, per cui lo switching capsulare evita la clearance immunitaria.9,10
È importante notare come l’incidenza della malattia causata da ceppi non capsulati di S. pneumoniae sia in crescita. Questi ceppi, normalmente presenti nella mucosa naso-faringea e raramente invasivi, stanno destando preoccupazione, dato il vantaggio selettivo che determina l’attuale vaccinazione. Gli attuali vaccini non hanno copertura verso questi ceppi acapsulati. Essi sono spesso causa di malattia invasiva, otiti medie e congiuntivite.
4. Clinica
La clinica è variabile da uno stato di portatore asintomatico a quello di patologia conclamata.
Lo stato di portatore asintomatico dipende da una serie di fattori come l’età, l’ambiente, la presenza di concomitanti infezioni virali o di malattie che alterano l’integrità della mucosa delle vie respiratorie e che riducono l’efficienza del sistema immunitario.
Quando il germe determina la patologia possono presentarsi sintomi aspecifici (astenia, tachicardia, dispnea, febbre) e locali (faringite, otite media, congiuntivite).
Nel caso in cui il batterio si localizzi nel sangue (batteriemia) o in distretti dove normalmente non è presente, la malattia può causare quadri clinici severi quali sepsi, meningiti, polmoniti, osteomieliti e artriti. Si definisce Malattia Pneumococcica Invasiva l’isolamento di S. pneumoniae da un sito normalmente sterile (sangue, liquido cefalorachidiano, liquido delle sierose).
La malattia pneumococcica invasiva colpisce più frequentemente i bambini sotto i due anni di età, adulti di età ≥ 65 anni, pazienti con sistema immunitario compromesso e pazienti con patologie croniche (diabete, cardiopatie, malattie del fegato, insufficienza renale, malattie del sangue, etc.).11 La polmonite è la manifestazione clinica più frequente, la sua comparsa è improvvisa e associata a sintomi aspecifici, quali brividi violenti e febbre elevata (39-41 °C).
La maggior parte dei pazienti manifesta tosse produttiva con espettorato striato di sangue e, in genere, dolore toracico associato all’infiammazione della pleura viscerale. Il quadro appena descritto rappresenta il decorso classico di un paziente adulto in buone condizioni di salute. Tuttavia, le categorie di bambini e anziani possono avere presentazioni differenti della malattia, che dipendono dallo stato immunitario e dalla presenza di eventuali comorbidità. In queste categorie, il quadro più comune è rappresentato da una broncopolmonite più generalizzata, associata ad una completa risoluzione radiologica in 2 o 3 settimane dopo terapia antimicrobica mirata.
Le complicanze di tale quadro possono essere, oltre alle pleuriti precedentemente nominate, piotorace, empiema saccato, ascessi, fibrosi (carnificazione dell’essudato) e sepsi.12
Quadri diversi dalla polmonite sono la sinusite e l’otite media, come conseguenze più comuni dell’infezione acuta dei seni paranasali e dell’orecchio. Queste vengono generalmente precedute da un’infezione virale del tratto respiratorio superiore, seguita da un’ostruzione dei seni e del canale dell’orecchio da parte di granulociti neutrofili polimorfonucleati.
L’infezione dell’orecchio medio (otite media) si riscontra principalmente nei bambini piccoli, mentre la sinusite batterica può verificarsi in pazienti di tutte le età. Streptococcus pneumoniae può ulteriormente diffondersi nel sistema nervoso centrale, in seguito ad una batteriemia dovuta o ad infezioni dell’orecchio medio o dei seni paranasali o ad un trauma. Il trauma può determinare una comunicazione non fisiologica tra spazio subaracnoideo e nasofaringe, tale da determinare un quadro meningitico. La meningite pneumococcica è relativamente poco diffusa nei neonati; tuttavia, è una delle principali cause di meningite in bambini e adulti.
Mortalità e gravi deficit neurologici risultano 4-20 volte più frequenti nei pazienti affetti da meningiti pneumococciche, rispetto alle meningiti provocate da altri microrganismi.13
5. Restistenze antibiotiche
Dopo che il PCV7 è stato aggiunto all’immunizzazione infantile di routine, la maggior parte dei dati di sorveglianza ha mostrato un calo della proporzione di isolati pneumococcici resistenti a penicillina e ad altri antibiotici. I dati dell’Active Bacterial Core Surveillance negli Stati Uniti indicano che la frequenza di IPD da ceppi penicillino-resistenti tra i bambini di età inferiore ai 5 anni è diminuita del 64% dopo l’introduzione dei vaccini; allo stesso modo, i tassi di IPD da ceppi penicillino-resistenti tra gli adulti di età ≥65 anni sono diminuiti del 45% nello stesso periodo, suggerendo un effetto gregge.
Nel periodo 2007-2008, quando ancora non era in uso il PCV13, il 97% delle IPD da ceppi penicillino-resistenti, tra bambini di età inferiore ai cinque anni, era attribuibile ai 6 sierotipi non presenti nel PCV7 (quasi esclusivamente sierotipo 19°).
Uno studio di sorveglianza condotto in 8 ospedali pediatrici negli Stati Uniti ha riscontrato un calo della proporzione di isolati resistenti a penicillina e a ceftriaxone, dopo l’introduzione del PCV13.
In un ulteriore studio, tra gli adulti di età ≥65 anni, i tassi di IPD con ceppi antibiotico resistenti attribuibili a sierotipi inclusi nel PCV13, ma non nel PCV7, è diminuito tra il 2009 e il 2013 da 4,4 a 1,4 casi ogni 100.000 abitanti.3
6. Vaccini
Storia dei vaccini e tipi di vaccini disponibili (efficacia, immunogenicità)
Il vaccino anti-pneumococco appartiene alla categoria di vaccini ad antigeni purificati.
Attualmente, in Italia non figura tra i vaccini obbligatori dell’età evolutiva; tuttavia, rientra di frequente tra le vaccinazioni offerte gratuitamente in determinate condizioni (età e patologia).
Ad oggi, esistono due vaccini in commercio: un vaccino polisaccaridico e un vaccino coniugato. La differenza tra vaccino polisaccaridico e coniugato è legata al livello di protezione: il primo dà una protezione meno duratura nel tempo, stimolando solamente i linfociti di tipo B; il secondo, stimolando anche i linfociti T, offre una protezione maggiore, sia per durata che per efficacia.14
Vaccino polisaccaridico
Il vaccino polisaccaridico è stato prodotto per la prima volta negli Stati Uniti, nel 1977. È costituito da antigeni capsulari purificati ed era diretto contro 14 sierotipi di pneumococco. Nel 1983, è stato integrato con ulteriori 9 sierotipi, arrivando al vaccino 23-valente (PPSV23), tuttora utilizzato, che ha rimpiazzato il precedente.
Può essere somministrato per via intramuscolare o sottocutanea.
Ogni dose contiene il fenolo come conservante, ma non contiene né adiuvanti né antibiotici.14
Efficacia e immunogenicità
È stato evidenziato che, successivamente all’utilizzo del PPSV23, più dell’80% degli adulti sani sviluppa una risposta anticorpale contro i sierotipi contenuti nel vaccino, generalmente entro 2 o 3 settimane dalla vaccinazione.
Nella popolazione anziana e negli individui con patologie croniche o immunodeficienze, le risposte anticorpali potrebbero non essere così efficaci. Gli anticorpi persistono elevati per almeno 5 anni in adulti sani, ma hanno un declino più veloce in persone con un certo grado di comorbidità. Il vaccino riesce a prevenire circa il 60-70% dei casi di malattia invasiva, causata da vari sierotipi; tuttavia, l’efficacia del vaccino è di molto ridotta nelle persone immunocompromesse. Il vaccino PPSV23 è ancora raccomandato, in associazione al vaccino coniugato, nei pazienti che hanno un rischio maggiore di sviluppare la malattia severa.14
Vaccino coniugato
Pochi anni più tardi, nel 2000, è stato prodotto un vaccino coniugato, che include nella sua composizione polisaccaridi purificati della capsula di 7 sierotipi di Streptococcus pneumoniae (PCV7), coniugati con la proteina CRM197, una variante non tossica della tossina difterica che usa una tecnologia simile a quella utilizzata nel vaccino anti-Haemophilus influenzae di tipo B e nel vaccino coniugato anti-meningococcico.
Nel 2010, c’è stata un’integrazione di questo vaccino coniugato con l’aggiunta di altri 6 sierotipi: 1, 3, 5, 6°, 7F e 19° (PCV13).
Il vaccino è somministrato per via intramuscolare; ogni dose contiene fosfato di alluminio come adiuvante. Non prevede nella sua composizione antibiotici o conservanti.14
Efficacia e immunogenicità
Un ampio studio clinico (pink book 14) ha dimostrato che PCV7 riduce del 97% l’incidenza della malattia invasiva, dovuta ai sierotipi contenuti nel vaccino.
Fra i bambini riceventi PCV7, sono stati registrati il 20% in meno di episodi di polmonite e il 7% in meno di episodi di otite media acuta, rispetto alle percentuali riscontrate tra i bambini non vaccinati.
PCV13 è stato concesso in licenza negli Stati Uniti sulla base di studi che hanno confrontato la risposta sierologica dei bambini che hanno ricevuto PCV13 con quella indotta nei bambini riceventi PCV7. Questi studi hanno evidenziato un’induzione dei livelli anticorpali paragonabili nei due vaccini, dimostrandone la protettività contro la malattia invasiva da pneumococco.14
In due studi randomizzati multicentrici14 di immunogenicità condotti negli Stati Uniti e in Europa, adulti immunocompetenti hanno ricevuto una singola dose di PCV13 o di PPSV23. Da questi studi è emerso che, negli adulti dai 60 ai 64 anni e dai 70 in avanti, PCV13 ha suscitato un’attività opsonofagocitica con titoli anticorpali medi paragonabili o superiori alle risposte suscitate da PPSV23. Persone che hanno ricevuto PPSV23 come dose iniziale con successiva somministrazione di una dose di PCV13 a distanza di un anno, presentavano una risposta anticorpale opsonofagocitica con titoli inferiori rispetto a coloro che avevano ricevuto PCV13 come dose iniziale.
Dall’introduzione della vaccinazione pediatrica con PCV13 nel 2010, l’incidenza della malattia invasiva, causata dai sierotipi vaccinali, è diminuita di oltre il 60% tra gli adulti di età pari o superiore a 65 anni.
Nel periodo 2008-2013, è stato condotto nei Paesi Bassi uno studio randomizzato14 controllato con placebo su circa 85.000 adulti di età superiore e uguale a 65 anni per valutare il beneficio clinico di PCV13 nella prevenzione della polmonite pneumococcica. I risultati di questo studio hanno dimostrato un’efficacia del 45,6% contro la polmonite pneumococcica dovuta a sierotipi contenuti nel vaccino, efficacia del 45% contro la polmonite pneumococcica di tipo non batteriemico, e del 75% contro l’IPD di tipo vaccinale.14,15 Le Figure 5 e 6, mostrano il numero di casi, con ceppo tipizzato, di malattia invasiva da pneumococco rispettivamente nei bambini 0-4 anni (totali e per sierotipi coperti dalla vaccinazione 13-valente e 10-valente) e in adulti >64 anni (totali e per sierotipi coperti dalla vaccinazione 13- e 23-valente) notificati nel periodo 2018-2020, in Italia. Nel 2020, si è osservata un’inversione di tendenza rispetto agli anni precedenti nei bambini di età compresa tra 0-4 anni, con un aumento nel numero di casi notificati causati da sierotipi prevenibili con la vaccinazione, dovuto probabilmente anche ad una leggera diminuzione della copertura vaccinale (90,6% nel 2020 e 92,0% nel 2019); negli adulti >64 anni, invece, a fronte di una percentuale di sierotipizzazione notevolmente ridotta, si registra un calo dei sierotipi vaccinali rispetto al biennio precedente.
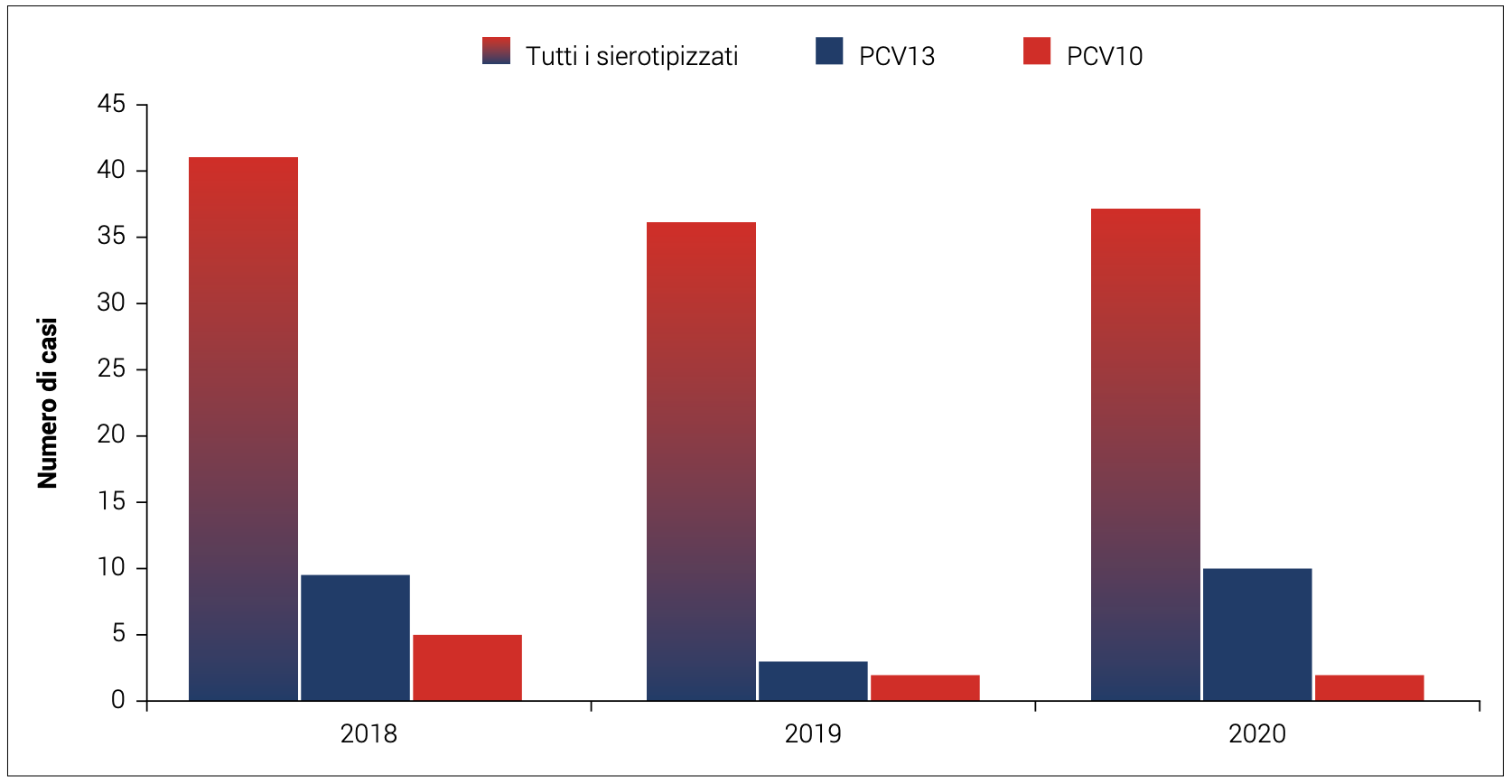 Figura 5. Numero di casi, con ceppo tipizzato, di malattia invasiva da pneumococco in bambini 0-4 anni (totali e per sierotipi coperti dalla vaccinazione 13 valente e 10 valente) notificati nel periodo 2018-2020, in Italia.4
Figura 5. Numero di casi, con ceppo tipizzato, di malattia invasiva da pneumococco in bambini 0-4 anni (totali e per sierotipi coperti dalla vaccinazione 13 valente e 10 valente) notificati nel periodo 2018-2020, in Italia.4
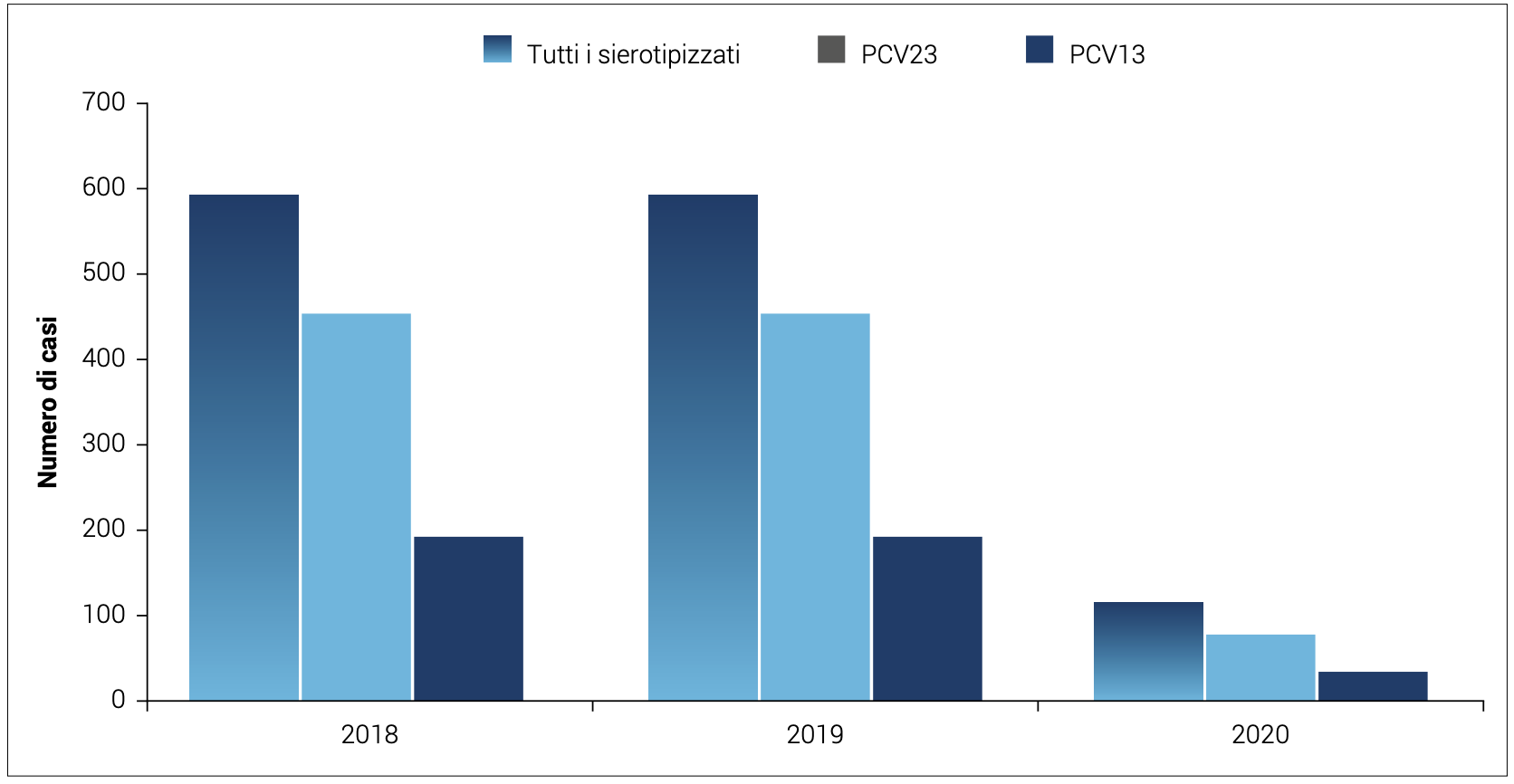 Figura 6. Numero di casi, con ceppo tipizzato, di malattia invasiva da pneumococco in adulti di età>64 anni (totali e per sierotipi coperti dalla vaccinazione 23 valente e 13 valente) notificati nel periodo 2018-2020, in Italia.4
Figura 6. Numero di casi, con ceppo tipizzato, di malattia invasiva da pneumococco in adulti di età>64 anni (totali e per sierotipi coperti dalla vaccinazione 23 valente e 13 valente) notificati nel periodo 2018-2020, in Italia.4
Vaccinazione adulti16-18
In Italia, la vaccinazione con PCV13 è raccomandata nei soggetti sani al compimento dei 65 anni e viene somministrata solitamente in concomitanza della vaccinazione antinfluenzale. A questa segue a distanza di un anno la somministrazione del PPSV23.
La vaccinazione anti-pneumococcica è raccomandata con una prima dose di vaccino PCV13 seguita, a distanza di almeno 8 settimane, da una dose di PPSV23 nei casi sottoelencati:
- Negli adulti con condizioni che aumentano il rischio di infezione da pneumococco o di gravi complicanze in caso di infezione, quali:
• Malattie cardiache croniche (insufficienza cardiaca, cardiomiopatia)
• Malattia polmonare cronica (asma, BPCO)
• Malattia epatica cronica
• Tabagismo
• Abuso di alcol - Nei pazienti con aumentato rischio di meningite dovuto alle seguenti condizioni:
• Posizionamento di impianto cocleare
• Perdita di liquido cerebrospinale
• Storia di meningite pneumococcica
• Precedente trauma cranico con conseguente difetto cranico e altre potenziali comunicazioni con lo spazio subaracnoideo - Nei soggetti con funzione splenica ridotta poiché, se si verifica un’infezione da pneumococco, può essere grave e fatale. Questi soggetti includono pazienti con:
• Asplenia anatomica e/o funzionale
• Anemia falciforme, o altre emoglobinopatie - Negli individui immunocompromessi, inclusi:
• Malattia Renale Cronica
• Infezione da HIV
• Leucemia, linfoma, mieloma multiplo
• Neoplasie maligne generalizzate (tumori solidi chemio-radiotrattati e/o metastatizzanti)
• Trapianto di organi
• Immunosoppresione iatrogena
• Immunodeficienza congenita o acquisita (deficit di linfociti B o T, deficit del complemento)
Sebbene nei pazienti immunocompromessi ci possa essere un’insufficiente risposta anticorpale, la vaccinazione è sempre raccomandata. Il vaccino coniugato deve essere somministrato sempre prima del polisaccaridico per garantire lo sviluppo anticorpale.
Vaccinazione dell’infanzia16,17,19
Il rischio di malattia pneumococcica invasiva (IPD), meningite e batteriemia è aumentato nei bambini di età inferiore a 5 anni (in particolare, inferiore a 2); pertanto, la vaccinazione è fondamentale in questa fascia d’età.
Da scheda tecnica AIFA, è possibile un programma di immunizzazione primaria a 3 o a 2 dosi.
In Italia, il programma di routine del calendario vaccinale indica la somministrazione in concomitanza alla vaccinazione esavalente: una prima dose di vaccino PCV13 al terzo mese di vita, una seconda dose al quinto mese e una terza dose all’undicesimo mese.
Il rischio di malattia pneumococcica invasiva è aumentato in bambini immunocompromessi compresi quelli con:
- Asplenia funzionale e/o anatomica
- Immunodeficienza congenita o acquisita
- Infezione da HIV
- Insufficienza renale cronica
- Sindrome nefrosica
- Neoplasie ematologiche o solide
- Immunodepressione iatrogena
Il rischio è, altresì, aumentato in bambini immunocompetenti con impianto cocleare e/o deficit della barriera anatomica ematoencefalica (perdita di liquido cerebrospinale). Un altro importante fattore di rischio di aumentata malattia pneumococcica invasiva è rappresentato da malattie croniche, in particolare:
- Cardiopatie croniche
- Malattie polmonari croniche
- Diabete mellito
- Malattia epatica cronica16,17
7. Controindicazioni ed effetti
Controindicazioni
La vaccinazione è controindicata in caso di reazione allergica grave (anafilassi) ad una precedente dose di vaccino o ad un suo componente.20,21
È opportuno rimandare la vaccinazione in presenza di malattie acute febbrili.20,21
Effetti collaterali
La vaccinazione è, di solito, ben tollerata. Le reazioni nella sede di iniezione compaiono entro 24-48 ore e possono essere: dolore, gonfiore, rossore, indurimento (nodulo). Sono possibili anche reazioni generali: febbre, irritabilità, dolori muscolari, rash (eruzioni cutanee), talvolta vomito, diarrea. Come per tutti i vaccini, non è possibile escludere l’eventualità di reazioni allergiche anche gravi, come lo shock anafilattico.20,21
8. Novità
Tra gli Obiettivi per lo Sviluppo Sostenibile (Sustainable Development Goals, SDG) da raggiungere entro il 2030, l’OMS ha incluso al terzo posto quelli di conseguire l’accesso a vaccini che siano sicuri, efficaci, di qualità ed economicamente accessibili.
Come noto, i vaccini coniugati hanno ridotto efficacemente l’incidenza della malattia pneumococcica invasiva e non; tuttavia, i sierotipi non inclusi nei vaccini, oggi in uso, sono associati ad un aumento della gravità ed invasività della malattia e allo sviluppo di resistenze antibiotiche. Considerato questo, nell’ottica di raggiungere una più ampia copertura dei vaccini coniugati, diversi laboratori stanno cercando di rielaborare i vaccini già in uso con l’aggiunta di nuovi sierotipi.
Due nuovi vaccini PCV stanno seguendo l’iter di approvazione per l’immissione in commercio:
- un vaccino coniugato 20 valente (PCV20) contenente i 13 sierotipi già presenti nel PCV13 più ulteriori 7 sierotipi (8, 10A, 11A, 12F, 15B, 22F E 33F).5
- un vaccino coniugato 15 valente che include i sierotipi già presenti in PCV13 e 2 sierotipi addizionali 22F e 33F. In entrambi sono inseriti i sierotipi 22F e 33F, sierotipi ad alta invasività e causanti molti casi di IPD.22
Esistono numerosi gruppi di ricerca indirizzati allo sviluppo di nuovi vaccini che sfruttino vie alternative ai soli sierotipi capsulari. Le alternative in lavorazione comprendono l’uso di vaccini con nuovi frammenti proteici, vaccini preparati con microrganismo intero, preparazioni poliantigeniche con nuovi sistemi di trasporto e combinazioni dei PCV con antigeni proteici.
Tra le proteine e le componenti pneumococciche in studio, possiamo menzionare le proteine leganti la colina (CBPs, choline binding proteins), le idrolasi mureiniche (LytA, LytB e LytC), la pneumolisina (dPly), le lipoproteine (PsaA), le neuraminidasi (Nan ABC), l’alfa glicerofosfato ossidasi (GlpO), le componenti del pilus pneumococicco (RrgA, RrgB e RrgC), il fattore di allungamento Tu (Tu fsp), la proteina legante i nucleosidi (PnrA) e la proteina di superficie K (PspK). Quest’ultima è importante, in quanto potrebbe essere un potenziale target per i ceppi non capsulati di S. pneumoniae. Come riscontrato in molti studi, una sola proteina non è sufficiente ad indurre una protezione completa contro tutti i ceppi pneumococcici. Per questo motivo, si stanno sperimentando diverse strade: alcune formulazioni proteiche multivalenti, dei tentativi di fusione di due o più proteine in una molecola chimera e anche delle combinazioni degli attuali PCV con proteine pneumococciche, che potrebbero fornire una risposta immune più duratura e più ampia. Per raggiungere lo scopo e, quindi, ampliare il numero di antigeni presentati, l’alternativa più logica sarebbe utilizzare un vaccino a microrganismo intero o la sua forma attenuata. In questo modo, gli antigeni si troverebbero, oltretutto, nella loro conformazione naturale, inducendo una maggior produzione di anticorpi e una risposta cellulare umorale. Per fare un esempio, un vaccino intero inattivato (Whole-Cell Vaccine, WCV) basato sul ceppo non capsulato di S. pneumoniae Rx1 e associato ad adiuvanti diversi, è stato in grado di ridurre la carica batterica nel nasofaringe e nell’orecchio medio e di proteggere contro polmoniti pneumococciche dovute a sierotipi multipli.
L’analisi del meccanismo difensivo ha dimostrato che lo stesso è dovuto all’induzione di anticorpi protettivi e alla risposta T-CD4 con produzione di IL-17A.
Inoltre, i vaccini del tipo WCV sembrano essere una strategia promettente per arrivare ad una copertura vaccinale sierotipo-indipendente che abbia costi di produzione contenuti, consentendo un accesso più agevole alla vaccinazione nei Paesi in via di sviluppo, finora limitata dai costi dei PCV. Oltre ai WCV, un altro indirizzo di studio è fornito dalla coniugazione dei polisaccaridi capsulari pneumococcici (CPS) con proteine pneumococciche. Tale coniugazione è in grado di offrire un’ampia protezione, col vantaggio di essere anch’essa sierotipo-indipendente, grazie all’inclusione di proteine pneumococicche conservate. Allo stesso tempo, conserva l’effetto gregge tipico dei vaccini coniugati.
Un altro campo di studio è quello della ricerca di nuovi adiuvanti e sistemi di trasporto. Quelli finora utilizzati negli esperimenti per veicolare le nuove proteine hanno dimostrato una bassa immunogenicità.
La prossima generazione di vaccini pneumococcici è oggetto di molta discussione circa la natura e il numero di antigeni da aggiungere, gli adiuvanti da utilizzare e i parametri dell’appropriatezza di ogni vaccino. Tuttavia, al centro della discussione una questione resta irrisolta e dibattuta: bisogna puntare all’eliminazione della colonizzazione da S. pneumoniae? Le strategie future terranno anche conto del doppio comportamento dello pneumococco nel nostro organismo, da una parte ospite innocuo colonizzante del nasofaringe e, dall’altra, causa di malattie invasive, anche fatali. Finora ci si è concentrati sull’eradicazione del batterio, eradicazione che, tuttavia, porta con sé anche l’eliminazione di colonie innocue. L’eradicazione completa di S. pneumoniae potrebbe portare ad un disequilibrio della flora batterica con una sostituzione da parte di altri batteri fino ad oggi limitati dalla presenza dello stesso streptococco. Una strategia più conveniente consisterebbe nel limitare la carica batterica streptococcica sotto un livello soglia, identificando le proteine pneumococciche iperespresse durante la fase invasiva, in modo da fermare la malattia senza avere effetto sulla colonizzazione.23


Evoluzione diversi 15 anni fa