Introduzione
Le malattie epatiche costituiscono l’undicesima causa di morte a livello mondiale, con oltre due milioni di decessi ogni anno dovuti a cirrosi, epatiti virali e carcinoma epatocellulare. Complessivamente, sono responsabili di circa il 4% di tutti i decessi globali, pari a 1 su 25.1 L’incidenza delle malattie epatiche croniche è in costante aumento, trainata soprattutto dalla crescente diffusione della malattia epatica alcol-correlata e della steatosi epatica associata a disfunzione metabolica (MASLD) oltre alla persistenza dei casi di epatite C non diagnosticata (nonostante il burden globale di HCV sia stato clamorosamente ridotto con la disponibilità dei DAAs). In Italia, gli ultimi dati disponibili riportano circa 17.000 decessi/anno per malattie del fegato; oltre il 70% causati da tumori epatici (in particolare, 23% epatocarcinoma, 26% altri tumori) e da cirrosi epatica (nel 24% dei casi) (Statistiche sociali e welfare ISTAT 2022). L’encefalopatia epatica (EE, Hepatic Encephalopaty - HE), caratterizzata da disfunzione cerebrale con disturbi neuropsichici di variabile gravità, è tra le più gravi e invalidanti complicanze della cirrosi scompensata e dell’insufficienza epatica avanzata ed è responsabile di ospedalizzazioni e riammissioni, con esiti spesso sfavorevoli.2-4 La prevenzione e il trattamento precoce della EE sono fondamentali e possono migliorare la prognosi dei pazienti.5
Un gruppo multidisciplinare di esperti ha affrontato la gestione e le implicazioni della malattia in un percorso di formazione articolato in tre incontri FAD ECM, parte del Progetto 2025 “HEpatic Lab Approccio sistematico all’encefalopatia epatica (EE): oltre la variabilità clinica”, realizzato con il contributo non condizionante di Alfasigma. Il presente articolo non intende riprodurre in maniera esaustiva quanto discusso nel corso della FAD, ma offrire un excursus sintetico e ragionato sulla malattia, evidenziandone i principali elementi clinici e terapeutici.
Definizione e classificazione HE
La EE è definita come una disfunzione cerebrale causata da insufficienza epatica e/o da shunt porto-sistemico, caratterizzata da un ampio spettro di alterazioni neurologiche e psichiatriche, con manifestazioni che possono variare da forme subcliniche fino al coma.6,7 Sono stati riportati casi di EE anche in pazienti con estesi shunt portosistemici nonostante l’assenza di cirrosi.8 La EE rappresenta una delle complicanze più frequenti della malattia epatica scompensata e comporta un marcato peggioramento della salute e della qualità della vita non solo dei pazienti, ma anche per i caregiver.9-11 È stato dimostrato che la EE è associata ad elevati tassi di mortalità indipendentemente dalla gravità della malattia epatica. Ciò suggerisce che essa non costituisce soltanto un sintomo dello scompenso epatico, ma possiede autonome implicazioni fisiopatologiche e prognostiche.2 La reale incidenza e prevalenza della EE non sono facilmente determinabili, poiché esse dipendono dalla variabilità dei sintomi, dagli strumenti diagnostici impiegati e dalla disomogeneità dei dati disponibili in letteratura.12 In uno studio di popolazione condotto negli Stati Uniti, l’incidenza è stata stimata pari a 11,6 casi per 100 pazienti-anno, con un incremento fino al 40% a cinque anni.13 I tassi di prevalenza di EE possono risultare significativamente più elevati nei pazienti sottoposti a shunt portosistemico intraepatico transgiugulare (TIPS), così come nei portatori di shunt spontanei o chirurgici.14-16 La prevalenza dell’EE conclamata al momento della diagnosi di cirrosi è del 10-14%, sale al 16-21% nei pazienti con cirrosi scompensata e raggiunge il 10-50% nei pazienti sottoposti a TIPS.2 È importante sottolineare che la EE può manifestarsi in qualsiasi stadio della cirrosi e che la sua prevalenza tende ad aumentare con il progredire della gravità della malattia epatica.6 La classificazione attualmente raccomandata della EE si basa sul tipo, sul grado di severità della manifestazione clinica, sull’andamento temporale e sui fattori precipitanti, quando identificabili. La EE viene classificata in tre tipi:
- Tipo A, associato ad insufficienza epatica acuta, spesso dovuta a sovradosaggio da paracetamolo, epatite virale acuta o cause vascolari;
- Tipo B, determinata da shunt portosistemici in assenza di malattia epatica sottostante;
- Tipo C, è la forma più comune, riscontrata in circa il 30-40% dei pazienti con cirrosi e caratterizzata da diversi gradi di severità.7,12,17
Dal punto di vista clinico, la classificazione più immediata distingue due stadi: covert e overt. Storicamente, tuttavia, la valutazione si è basata sui criteri di West Haven, che articolano l’EE in quattro gradi di gravità.7,18 L’encefalopatia epatica di tipo C è una sindrome neurologica complessa, tipica dei pazienti con malattia epatica avanzata, che si manifesta con un ampio spettro di alterazioni neurologiche e psichiatriche aspecifiche, variabili da una forma subclinica, l’encefalopatia epatica minima (MHE, Minimal Hepatic Encephalopathy), fino alla forma più grave, caratterizzata da un’alterazione dello stato di coscienza, ossia l’encefalopatia epatica conclamata (OHE, Overt Hepatic Encephalopathy).12 La MHE è frequente, con una prevalenza stimata tra il 20% e l’80% dei pazienti, in funzione degli strumenti diagnostici utilizzati. Nonostante la natura subclinica, la MHE ha un impatto clinico rilevante, poiché aumenta il rischio di cadute, riduce l’idoneità alla guida e la capacità lavorativa, si associa a sarcopenia e influisce negativamente sulla prognosi. Inoltre, peggiora la qualità di vita dei pazienti e dei caregiver, incidendo anche sullo stato socioeconomico.19,21 Recentemente è stato introdotto il termine “covert” per unificare la MHE e la EE di grado I, al fine di indicare una condizione non clinicamente evidente, ma neppure manifesta. Sia la MHE sia la EE covert sono considerate rilevanti fattori di rischio per lo sviluppo di OHE: il 5-25% dei pazienti sviluppa infatti OHE entro 5 anni dalla diagnosi di cirrosi.22,23 (Figura 1)
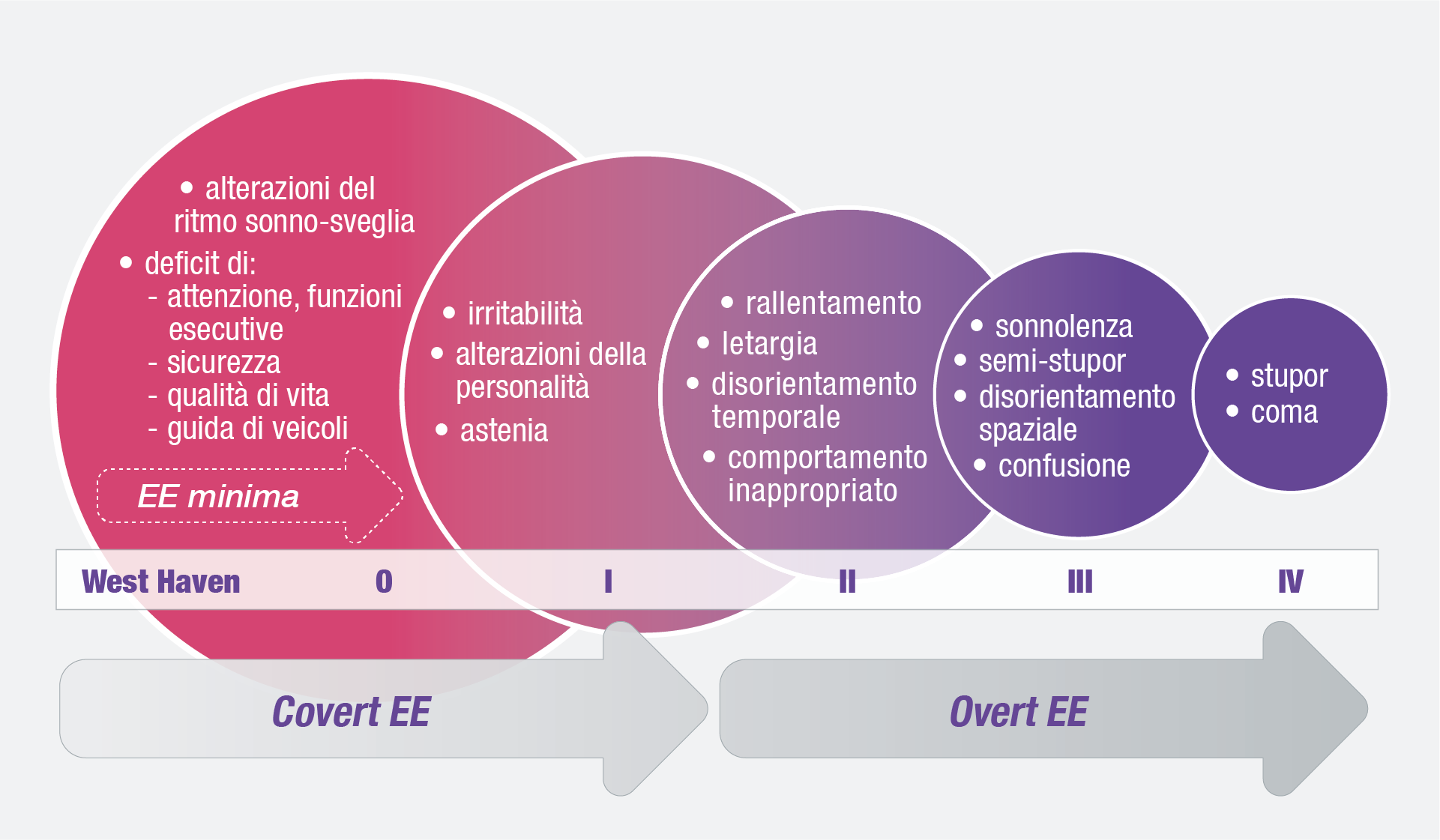 Figura 1. Classificazione della EE in base al peggioramento della funzione cognitiva
Figura 1. Classificazione della EE in base al peggioramento della funzione cognitiva
In relazione all’andamento temporale, la EE può essere ulteriormente classificata come:
- episodica, se insorge in presenza di un fattore precipitante identificabile;
- ricorrente, quando gli episodi si verificano a distanza di ≤6 mesi;
- persistente, se i sintomi sono costanti, con eventuali riacutizzazioni di EE conclamata.12 (Figura 2)
 Figura 2. Classificazione della EE in base al tipo, alla severità e al timing
Figura 2. Classificazione della EE in base al tipo, alla severità e al timing
ICU: Intensive Care Unit (Unità di Terapia Intensiva); WH: West Haven (Classificazione di West Haven, utilizzata per definire il grado di EE)
Patogenesi e Fisiopatologia
La EE presenta una fisiopatologia complessa e ancora non del tutto chiarita.2,5 L’iperammoniemia rappresenta il principale fattore responsabile, ma non esclusivo poiché infiammazione sistemica e neuroinfiammazione, stress ossidativo e senescenza cellulare concorrono in maniera sinergica allo sviluppo della malattia.2,18 In particolare, infezione e infiammazione sono influenzati dall’interazione tra il microbiota intestinale e la barriera epiteliale intestinale, la cui disfunzione determina un passaggio continuo di materiale patogeno dal lume intestinale, innescando una risposta infiammatoria sistemica.18 Risultano, inoltre compromessi la permeabilità e la funzione della barriera emato-encefalica, la composizione del liquido cerebrospinale, il flusso glinfatico, il metabolismo energetico cerebrale, la neurotrasmissione e la comunicazione intercellulare, determinando conseguenti deficit neurologici e identificando potenziali bersagli terapeutici.2 In condizioni fisiologiche l’ammoniaca, prodotta dal microbiota intestinale, viene convertita in glutammina a livello epatico prevenendone così la diffusione nella circolazione sistemica. Gli epatociti periportali la convertono, attraverso il ciclo dell’urea, in urea che viene successivamente eliminata con le urine o a livello intestinale.24 Nella cirrosi, sostanze normalmente escluse dal passaggio attraverso la barriera penetrano nel cervello, mentre altre, come l’ammoniaca, si accumulano in eccesso stimolando vie fisiopatologiche con effetti deleteri. L’ammoniaca esercita effetti neurotossici diretti (eccitatori e inibitori), sinergici con altre neurotossine che aumentano per ridotta detossificazione epatica (mercaptani, fenoli, acidi grassi a catena corta).2 Gli shunt portosistemici riducono la pressione portale ma bypassano il fegato, impedendo la detossificazione delle sostanze tossiche. L’ammoniaca in eccesso attraversa la barriera ematoencefalica, viene metabolizzata dagli astrociti a glutammina con aumento dell’osmolarità e rigonfiamento cellulare fino all’edema cerebrale. Inoltre, altera la neurotrasmissione, compromettendo metabolismo energetico e degli amminoacidi. Sono stati descritti anche squilibri della neurotrasmissione (ridotta attività glutammatergica, iperattività GABAergica, interferenze con serotonina e dopamina), la produzione di neurosteroidi in condizioni di iperammoniemia e l’accumulo di manganese nei gangli della base, che contribuisce al deficit cognitivo.2 Studi recenti hanno messo in evidenza il ruolo di altri meccanismi coinvolti nella fisiopatologia dell’encefalopatia epatica (EE), quali l’infiammazione sistemica e la disbiosi del microbiota intestinale.25,26 Queste alterazioni determinano la produzione di elevate concentrazioni di citochine pro-infiammatorie che, agendo in sinergia con l’iperammoniemia, attraversano la barriera emato-encefalica e inducono edema cellulare.25-28
Quadro clinico, diagnosi differenziale e fattori precipitanti della EE
La diagnosi di EE non è sempre immediata, poiché può sovrapporsi ad altre condizioni mediche, neurologiche e psichiatriche in grado di determinare disfunzione cerebrale.3 È fondamentale raccogliere un’anamnesi accurata, anche con l’aiuto di familiari o caregiver, per individuare episodi precedenti di EE o una malattia epatica nota o sospetta. L’esame clinico rappresenta un elemento centrale nella diagnosi di EE (tremore a battito d’ali, disorientamento spazio-temporale, alterazioni della personalità, sonnolenza, confusione, coma). Cruciale è la diagnosi differenziale che deve includere patologie in grado di simulare l’EE, tra cui alterazioni elettrolitiche, ipercapnia, psicosi, demenza, meningoencefalite, intossicazioni da alcol o farmaci, masse cerebrali, malattia di Wilson.3 Nella maggior parte dei casi, i pazienti con cirrosi ed EE presentano un quadro tipico con iperammoniemia, segni di scompenso (es. ascite) e/o presenza di shunt porto-sistemici. In assenza di questi elementi, il clinico deve considerare in modo sistematico altri fattori o co-fattori di delirium subsindromico e coma. Tra questi rientrano: infezioni (es. sepsi), infiammazione non infettiva (es. vasculite), carenze nutrizionali (es. tiamina), fattori di rischio per altre encefalopatie metaboliche (es. uremia, ipoglicemia, tossicità da farmaci), ipossia o ipotensione (es. insufficienza cardiaca o sindrome epatopolmonare grave), traumi o patologie cerebrovascolari (es. ematoma subdurale).29 Il primo episodio di OHE viene riportato nel 25% dei pazienti entro 5 anni dalla diagnosi, in relazione alla presenza di fattori precipitanti quali infezioni, sanguinamento gastrointestinale, uso eccessivo di diuretici, disordini elettrolitici, costipazione, shunt porto-sistemici, TIPS o farmaci ad azione sul sistema nervoso centrale (es. oppiacei, benzodiazepine).12,30 La MHE è caratterizzata da deficit neurocognitivi sfumati, quali lievi compromissioni dell’attenzione, della velocità psicomotoria e delle funzioni esecutive. Queste alterazioni cognitive possono essere rilevate mediante test neuropsicologici specifici, ma non risultano generalmente evidenti all’esame clinico routinario. Nonostante l’assenza di sintomi manifesti, la MHE può comunque compromettere le attività quotidiane e la qualità di vita del paziente.3 Il work-up diagnostico può includere i seguenti esami: emocromo completo, elettroliti, glicemia, markers di infiammazione (ad esempio proteina C-reattiva o VES), alcolemia e screening per sostanze psicoattive e dosaggio dell’ormone tireotropo (TSH).3 Il dosaggio dell’ammoniemia, pur non correlando sempre con la gravità clinica, resta un parametro utile se integrato con l’osservazione clinica, soprattutto nei casi sospetti. Non esistono segni radiologici specifici di EE, ma la TC o la RM possono essere eseguite in caso di dubbi diagnostici e per escludere altre cause di disfunzione cerebrale acuta. Il tracciato elettroencefalografico (EEG) evidenzia solitamente un’attività diffusa a onde lente, riscontrabile anche nelle forme lievi di encefalopatia. Tale reperto risulta sensibile, ma non specifico, nelle fasi iniziali della malattia. La diagnosi precoce e il trattamento consentono di migliorare la vita quotidiana dei pazienti e di prevenire i ricoveri correlati all’EE.31
Gestione terapeutica del paziente con EE
Le strategie attuali di gestione della EE comprendono l’identificazione, la prevenzione e la correzione dei fattori precipitanti, l’impiego di lattulosio e rifaximina sia a fini terapeutici sia di profilassi, e, nei pazienti con malattia epatica allo stadio terminale e con EE ricorrente o persistente non responsiva al trattamento, il trapianto di fegato.7 La correzione dei fattori precipitanti deve sempre precedere la terapia specifica e, nella maggior parte dei casi, è sufficiente a determinare la risoluzione dell’episodio di EE conclamata.7 Contestualmente, deve essere avviata la terapia con disaccaridi non assorbibili, in particolare lattulosio, un catartico osmotico in grado di ridurre la produzione e l’assorbimento intestinale di ammonio. Dopo un primo episodio di EE, è indispensabile avviare tempestivamente la profilassi secondaria durante il ricovero, al fine di prevenire ulteriori recidive. Il lattulosio è raccomandato come profilassi secondaria e deve essere titolato per ottenere 2-3 evacuazioni al giorno. Negli ultimi dieci anni la gestione della EE si è evoluta con l’inclusione della rifaximina nelle linee guida internazionali.7 Questo antibiotico non assorbibile ad ampio spettro, appartenente alla classe delle rifamicine, è raccomandato in associazione al lattulosio come profilassi secondaria dopo uno o più ulteriori episodi di OHE entro 6 mesi dal primo, al dosaggio di 550 mg due volte al giorno. L’azione della rifaximina è multifattoriale: riduce la popolazione di batteri intestinali produttori di ammoniaca, esercita un effetto antinfiammatorio attenuando la neuroinfiammazione e contribuisce al ripristino della barriera intestinale, limitando la traslocazione batterica ed endotossinica nel circolo sistemico. Un RCT recente32 ha dimostrato che tali meccanismi favoriscono non solo la risoluzione degli episodi di EE, ma anche la prevenzione delle recidive, riducendo il rischio di infezioni e di infiammazione sistemica. Ad oggi non esistono raccomandazioni per la profilassi primaria della EE nei pazienti con malattia epatica avanzata. Tuttavia, studi recenti hanno suggerito l’importanza in casi selezionati, come in presenza di sanguinamento gastrointestinale o prima di un TIPS non urgente in pazienti con cirrosi e pregressi episodi di OHE. In caso di ricorrenti episodi di EE, scarsamente responsivi al trattamento, in presenza di insufficienza epatica, l’indicazione è il trapianto di fegato. Parallelamente alla terapia specifica, devono essere adottate tutte le misure utili a controllare la progressione della EE.
Nutrizione e prevenzione della sarcopenia
La gestione nutrizionale rappresenta un elemento cruciale nella cura del paziente con cirrosi e, in particolare, nei soggetti affetti da EE. Nei pazienti malnutriti l’incidenza di EE è significativamente più elevata, poiché la riduzione della massa muscolare (sarcopenia) compromette la capacità di rimozione periferica dell’ammoniaca.33,34 Il muscolo scheletrico, infatti, contribuisce alla detossificazione dell’ammoniaca attraverso la sintesi di glutammina mediata dalla glutammina sintetasi. L’iperammoniemia può a sua volta compromettere la funzione muscolare e favorire la perdita di massa, instaurando un circolo vizioso tra sarcopenia e EE.35 (Figura 3)
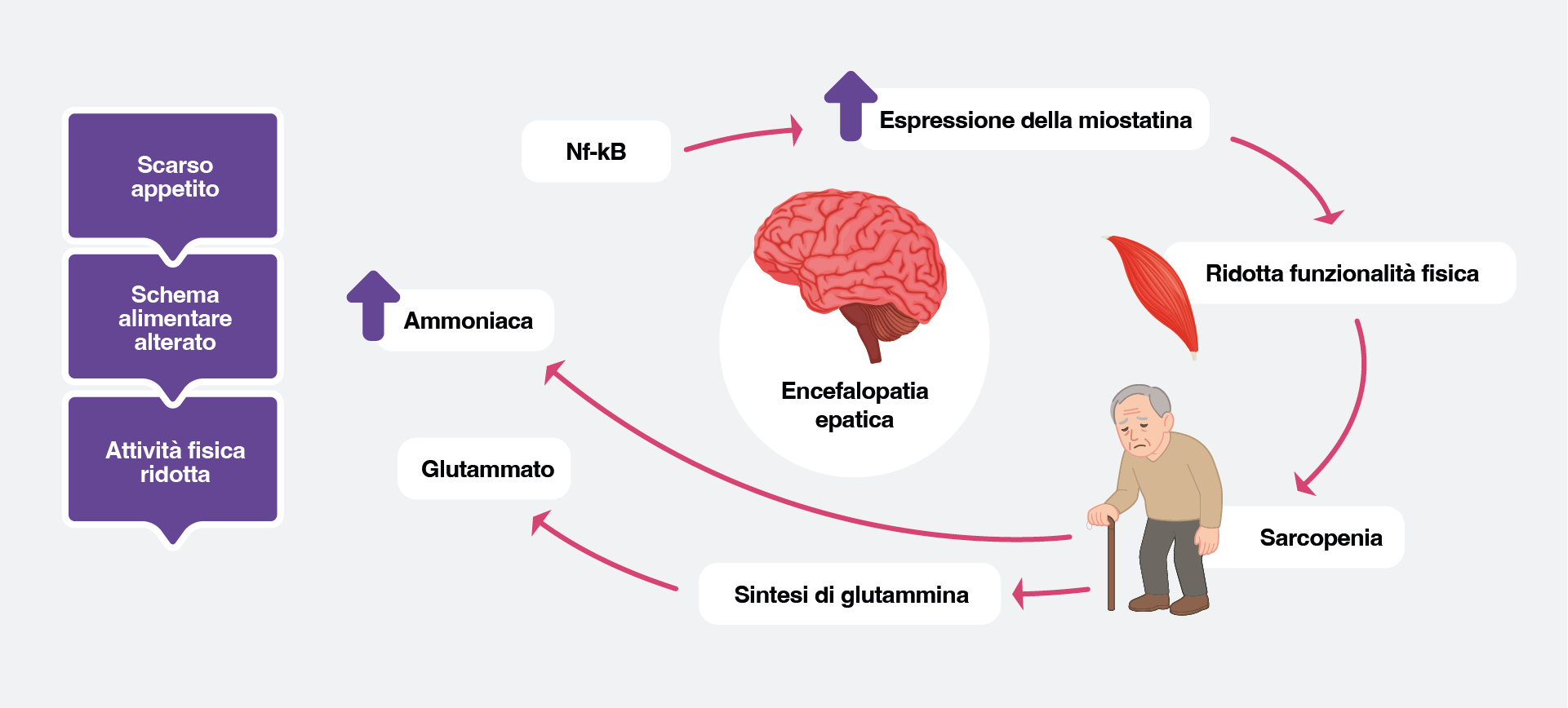 Figura 3. Relazione reciproca tra EE, sarcopenia, riduzione dello stato funzionale e alterato apporto nutrizionale
Figura 3. Relazione reciproca tra EE, sarcopenia, riduzione dello stato funzionale e alterato apporto nutrizionale
La malnutrizione proteico-energetica e la sarcopenia sono estremamente frequenti nei pazienti con EE, con una prevalenza che può superare il 75% per la malnutrizione e oscillare tra il 40% e il 70% per la sarcopenia, a seconda dei criteri diagnostici e della gravità della malattia. Entrambe le condizioni si associano a una prognosi sfavorevole, a una ridotta risposta terapeutica e a un rischio più elevato di recidiva di EE.36,37 La sarcopenia e la miosteatosi (infiltrazione del tessuto muscolare da parte di grasso inter- e intramuscolare) sono oggi riconosciute come fattori precipitanti indipendenti di EE, e in particolare, la sarcopenia aumenta di due-tre volte il rischio di sepsi e mortalità.35,37 Data la stretta relazione tra EE, malnutrizione e sarcopenia, è raccomandata una valutazione nutrizionale precoce nei pazienti con malattia epatica avanzata, con l’obiettivo di garantire un adeguato apporto calorico e proteico per prevenire il peggioramento delle condizioni metaboliche e funzionali.37 Le linee guida EASL (2019) raccomandano, nei pazienti non obesi con cirrosi, un apporto calorico giornaliero di 30-40 kcal/kg/die, con un introito proteico di 1-1,5 g/kg/die, privilegiando proteine di origine vegetale e lattiero-casearia.38 I pazienti dovrebbero evitare lunghi periodi di digiuno e suddividere l’apporto calorico e proteico in pasti piccoli e frequenti; la colazione e lo spuntino serale dovrebbero sempre includere una quota proteica, al fine di mantenere un bilancio azotato adeguato e ridurre il rischio di catabolismo muscolare.38 Oltre alla supplementazione nutrizionale, l’aumento dell’attività fisica e dell’esercizio rappresenta anch’esso uno stimolo anabolico in grado di migliorare la massa e la funzionalità muscolare.38 Nonostante l’impatto dimostrato della nutrizione sulla prognosi e sull’evoluzione clinica, questo aspetto è spesso affrontato tardivamente, quando la malnutrizione è già conclamata. È quindi fondamentale un approccio multidisciplinare, che includa la consulenza nutrizionale fin dalle fasi iniziali della malattia, al fine di prevenire la comparsa di sarcopenia e di altre complicanze correlate alla cirrosi, tra cui la stessa encefalopatia epatica.37
Approccio multidisciplinare e continuità assistenziale
I pazienti con malattie croniche complesse, come la EE, necessitano di una presa in carico precoce, continuativa ed efficiente, che garantisca appropriatezza terapeutica, equità di accesso e sostenibilità economica. Per raggiungere questi obiettivi sono fondamentali il coordinamento dell’assistenza, lo sviluppo di sistemi di sanità pubblica e di medicina personalizzata per ridurre le diseguaglianze, nonché l’accesso tempestivo ai farmaci più efficaci per evitare un aggravio dei costi di gestione. (Figura 4)
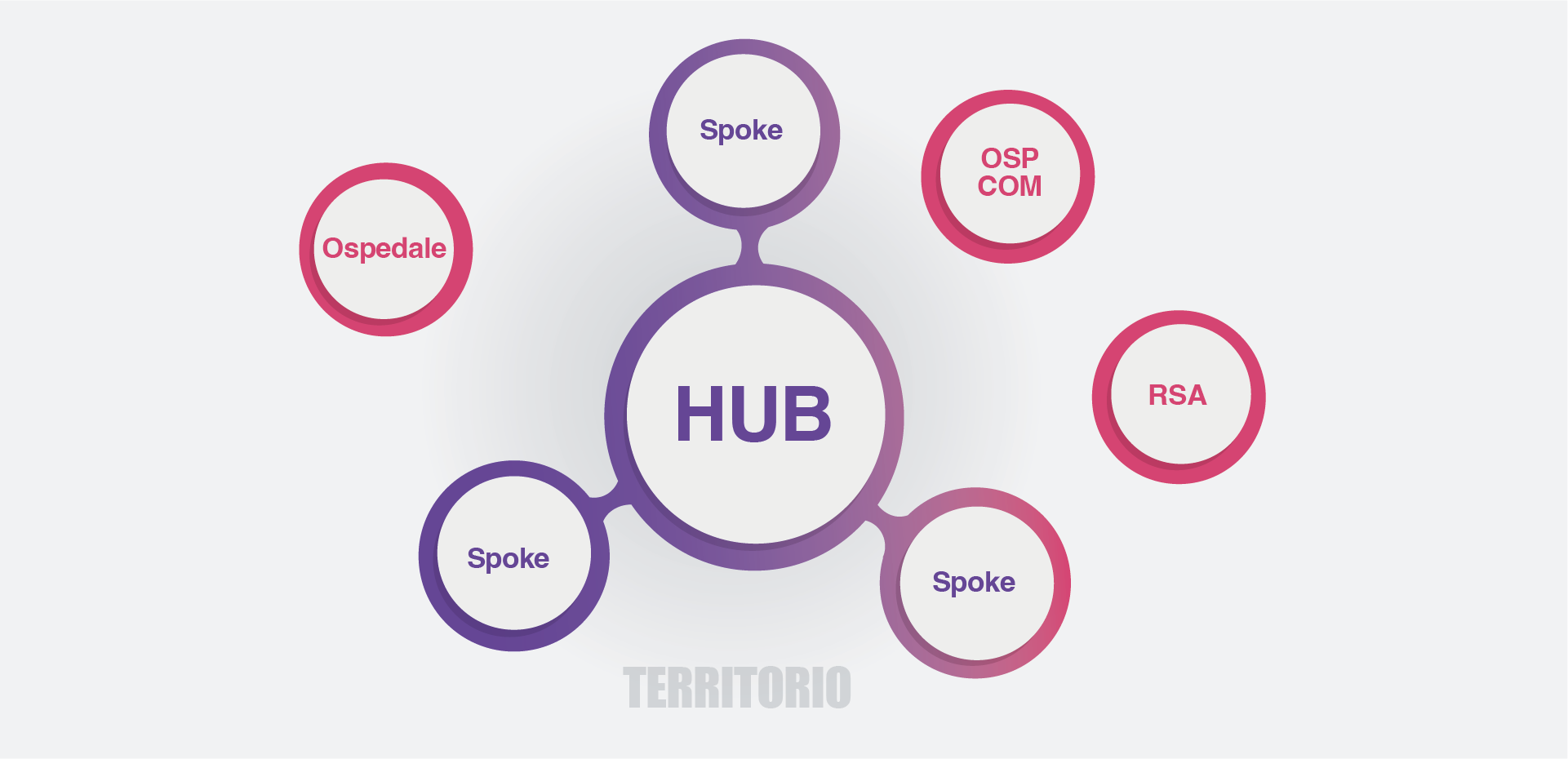 Figura 4. Organizzazione della rete dei percorsi di assistenza
Figura 4. Organizzazione della rete dei percorsi di assistenza
L’inquadramento iniziale ed in itinere del paziente richiede la valutazione della complessità della malattia, l’individuazione dei livelli assistenziali più appropriati e una stratificazione dinamica che tenga conto dello stato di salute generale e del carico assistenziale. Il Medico di Medicina Generale ha un ruolo centrale nella gestione condivisa con gli specialisti: prende in carico il paziente in trattamento, quello differibile, il non candidabile, il paziente con complicanze, il candidato al trapianto e il trapiantato. La rete assistenziale deve garantire trasparenza delle procedure diagnostiche e la tracciabilità delle decisioni terapeutiche, attraverso criteri di priorità per l’accesso alle cure e un follow-up adeguato. La gestione del paziente con EE deve prevedere un approccio multidisciplinare che coinvolga epatologi, nutrizionisti, fisioterapisti, infermieri e caregiver, poiché l’aderenza al piano terapeutico resta una delle principali criticità nei pazienti con cirrosi avanzata. Un aspetto rilevante riguarda inoltre l’impatto dell’ospedalizzazione: i costi per la gestione di un paziente con EE possono superare i 14.000 euro l’anno. Le infezioni, spesso acquisite in ambiente ospedaliero, rappresentano una complicanza quasi “strutturale” della cirrosi e possono innescare l’insorgenza di acute-on-chronic liver failure (ACLF), con coinvolgimento multiorgano e alta mortalità; anche infezioni apparentemente minori, come quelle urinarie, possono accelerare il declino clinico. È quindi fondamentale rafforzare i percorsi di gestione territoriale, ridurre i ricoveri non necessari e garantire una presa in carico precoce ed efficace. In quest’ottica, strumenti semplici come l’Animal Naming Test, già validato a livello internazionale, consentono il riconoscimento precoce dei disturbi cognitivi e possono essere utilizzati anche dai Medici di Medicina Generale.
Conclusioni
L’encefalopatia epatica è una sindrome che può insorgere in corso di danno epatico acuto sia cronico. Rappresenta una delle complicanze più rilevanti e una causa importante di mortalità nei pazienti con cirrosi, con un impatto marcato sulla qualità di vita dei pazienti e dei loro familiari. Negli ultimi decenni si è accumulata un’ampia evidenza a supporto della teoria del sinergismo tra infiammazione e ammoniemia nella sua patogenesi. Parallelamente, è emerso in modo sempre più chiaro il ruolo della malnutrizione e della sarcopenia, condizioni estremamente frequenti nei pazienti con cirrosi, che contribuiscono alla disfunzione metabolica, aumentano il rischio di recidiva di EE e sono associate a una prognosi sfavorevole. Il mantenimento di uno stato nutrizionale adeguato, con un apporto proteico sufficiente e una distribuzione corretta dei pasti, rappresenta oggi un elemento fondamentale della gestione del paziente con EE. Anche la gestione farmacologica si è evoluta con l’inserimento della rifaximina nelle linee guida terapeutiche. Il riconoscimento precoce e la prevenzione dei fattori precipitanti, insieme alla combinazione rifaximina + lattulosio, rappresentano tuttora il cardine del trattamento. Sebbene, quindi, la comprensione dei meccanismi fisiopatologici sia notevolmente progredita, il trattamento rimane incentrato principalmente sul controllo dell’ammoniemia e dell’infiammazione. La ricerca futura dovrà concentrarsi sull’integrazione di strategie mirate alla neuroinfiammazione, sulla modulazione del microbiota intestinale e sul ruolo della nutrizione nel miglioramento della prognosi complessiva.


Lascia un commento