Introduzione
La Sclerosi Multipla (SM) è una malattia infiammatoria cronica del sistema nervoso centrale (SNC) caratterizzata da demielinizzazione, perdita assonale e neurodegenerazione. Il decorso interindividuale della malattia è estremamente variabile, potendosi identificare sia soggetti che accumulano disabilità motoria e cognitiva in breve tempo, sia altri che presentano foci di demielinizzazione a carico del SNC senza sintomi o segni neurologici obiettivabili. Nel complesso, tuttavia, la SM si configura come la principale causa di disabilità neurologica progressiva nella popolazione giovane adulta. L’età di esordio è infatti tipicamente compresa tra i 20 ed i 40 anni, pur essendo documentati casi ad esordio in età infantile o adolescenziale ed in persone con età superiore ai 50 anni. La SM è più circa 2-3 volte più frequente nel sesso femminile che in quello maschile.1
Pur rappresentando una condizione eterogenea in termini di presentazione ed evoluzione clinica, si possono riconoscere fondamentalmente tre decorsi di malattia: recidivante-remittente (RR), secondariamente progressivo (SP) e primariamente progressivo (PP).2 La SM esordisce nella maggioranza (85-90%) dei casi con decorso RR, caratterizzato dalla comparsa di disturbi neurologici acuti o subacuti (ricadute di malattia) con transitorio o permanente accumulo di disabilità, intervallati da fasi di remissione più o meno completa dei segni e sintomi. Il decorso SP, caratterizzato da un progressivo incremento della disabilità indipendentemente dalle ricadute di malattia, segue nel 30-50% dei casi il decorso RR, anche se l’introduzione dei disease-modifying treatments (DMTs) sta significativamente riducendo la proporzione di pazienti che vanno incontro a questa transizione.3 Il decorso PP colpisce circa il 10-15% delle persone con SM e si caratterizza per la continua progressione della disabilità, fin dall’esordio di malattia, in assenza di chiare fasi di ricadute; le persone colpite da questa forma di malattia, in media, tendono ad avere un esordio dei sintomi tardivo (intorno ai 50 anni) e il rapporto uomini/donne tende ad essere 1:1.
L’epidemiologia della SM sta cambiando
Le più recenti stime riportano che almeno 2,3 milioni di persone nel mondo siano affette da SM, con una prevalenza di 80-170 casi per 100.000 abitanti in Europa Occidentale, Nord America, Australia e Nuova Zelanda, mentre la prevalenza si attesta al di sotto dei 30 casi per 100.000 abitanti in Asia, Africa sub-sahariana, America Centrale.4 Storicamente viene descritto un gradiente latitudinale per cui la prevalenza aumenta nelle regioni più lontane dalle zone equatoriali, dove invece la malattia è quasi sconosciuta; tuttavia tale gradiente geografico è stato messo recentemente messo in discussione.5
In Italia sono circa 133.000 le persone affette da SM, con una prevalenza stimata di 215 casi per 100.000 abitanti ed una incidenza di 3.600 nuovi casi all’anno.6
Alcuni studi indipendenti hanno documentato un incremento dell’incidenza della SM nelle ultime decadi (Figura 1/A), in particolare stanno aumentando i casi di SM-RR ad esordio tardivo, ossia dopo i 50 anni (cosiddetti ‘late-onset’) e addirittura dopo i 60 anni (cosiddetti ‘very late-onset’) di età, in particolare nel sesso femminile (Figura 1/B).7-9
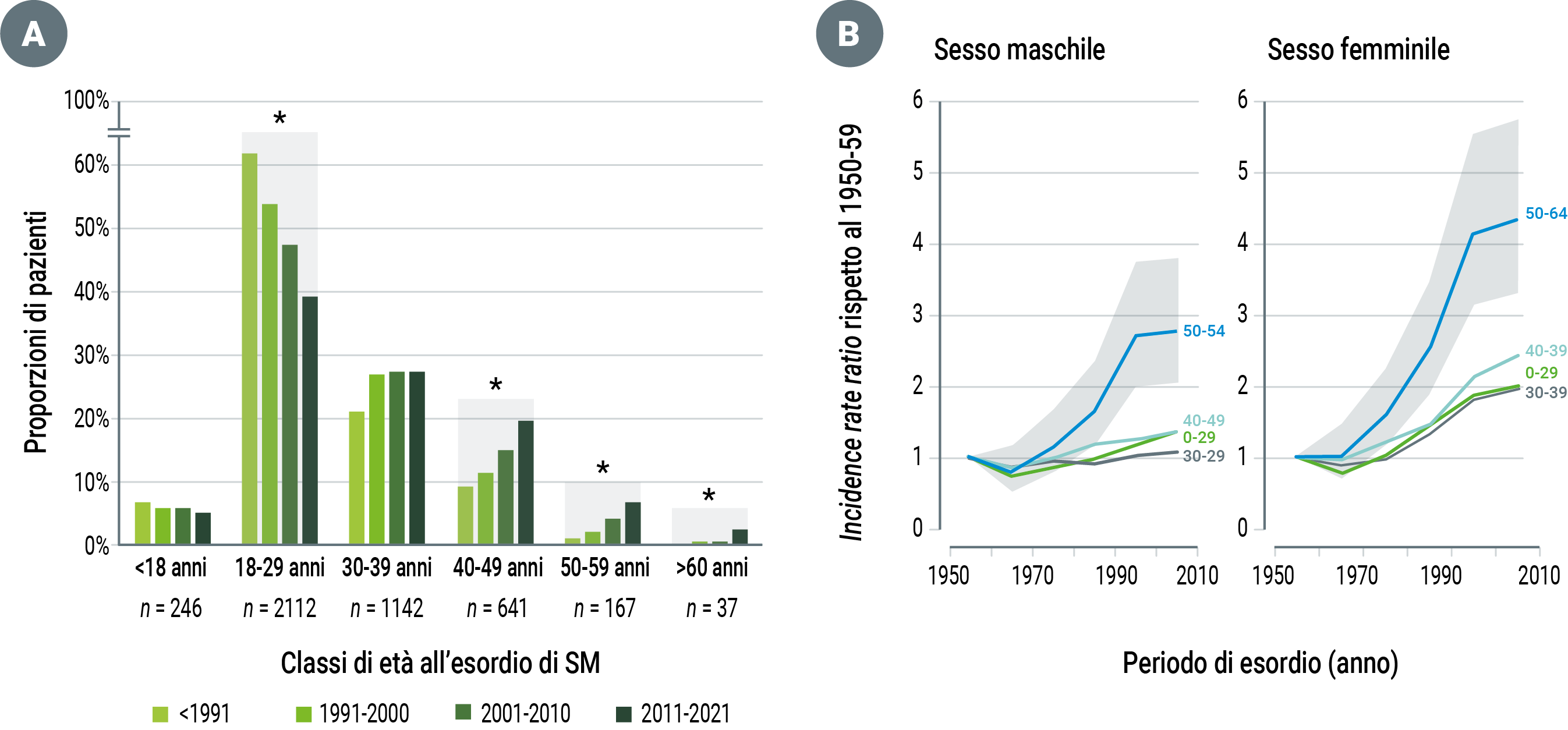
Figura 1. Incidenza della Sclerosi Multipla per classi di età in due popolazioni indipendenti di Roma, Italia (A) e Danimarca (B): negli ultimi anni è aumentato il numero di SM ad esordio tardivo, specialmente nel sesso femminile [modificato da 7,8].
Le spiegazioni plausibili per questo incremento di incidenza sono molteplici e probabilmente non mutualmente esclusive:
- l’evoluzione dei criteri diagnostici, che ha permesso un riconoscimento sempre più precoce della patologia in tutte le classi di età, comprese quelle più anziane (basti pensare che vecchi criteri diagnostici di Schumacher consideravano un criterio di esclusione per la diagnosi di SM l’esordio di sintomi neurologici dopo i 50 anni di età);
- l’incrementato accesso alla diagnostica per immagini mediante Risonanza Magnetica (RM), esame cardine ai fini diagnostici per la SM;
- mutamenti nello stile di vita della popolazione che abbiano modificato la suscettibilità nei confronti della malattia, in particolare consumo di sigarette, numero di gravidanze, obesità in età adolescenziale, esposizione alla luce solare, infezioni.10
Un altro tema di discussione è se si tratti di diagnosi tardive o di reali esordi clinici tardivi. In realtà, l’evoluzione dei criteri diagnostici sembra indicare piuttosto la seconda possibilità, alla luce del fatto che, nell’ultimo decennio, l’aumento dell’età media al primo evento demielinizzante si è accompagnato ad una riduzione del tempo medio trascorso tra esordio clinico e diagnosi di SM.7 Ad esempio, nel decennio 1991-2000 l’età media alla diagnosi era di circa 30 anni e il tempo tra esordio clinico e diagnosi era di circa 4 anni, mentre nell’ultimo decennio tali valori si sono attestati a circa 35 anni e 1 anno, rispettivamente.
L’aumento dell’incidenza, in particolare dei casi late-onset, sommato alla maggiore longevità (soprattutto nei Paesi ad alto reddito), si traduce in un aumento della prevalenza e dell’età media delle persone con SM. Infatti, sebbene alcuni studi di storia naturale abbiano riportato, in media, una riduzione della longevità di circa 6-10 anni per le persone affette da SM11, il tasso di letalità della malattia si è sensibilmente ridotto nelle ultime decadi.4 Secondo uno studio condotto negli Stati Uniti, la popolazione ‘over-50’ affetta da SM rappresenterebbe la classe di età prevalente.12
Un recente report italiano relativo ai dati di un Centro di terzo livello per la diagnosi e cura della SM in Italia ha documentato che circa 11% dei 2.378 pazienti in carico ha più di 60 anni, e che circa un terzo di questi pazienti ha un decorso RR di malattia ed è ancora in trattamento con DMTs.13
Considerando questi dati ragionevolmente rappresentativi della realtà italiana, e partendo dall’assunto che le persone con SM in Italia sono circa 133.000 (dati AISM 2023)6, possiamo stimare che in Italia ci siano approssimativamente 14.000 pazienti ‘over-60’ con SM, di cui oltre 4.500 con decorso RR e in trattamento con DMTs.
Se si ragiona in termini di durata di malattia, i pazienti con SM late-onset raggiungono milestones di disabilità in tempi più rapidi rispetto a pazienti con esordio classico o pediatrico. Tuttavia, se si ragiona in termini di età anagrafica, i pazienti con SM late-onset raggiungono determinati livelli di disabilità ad un’età più avanzata rispetto agli altri pazienti14 (Figura 2). Questa discrepanza non è banale in considerazione del fatto che la durata di malattia è calcolata sull’esordio clinico, un evento che non solo è suscettibile di recall bias in quanto riferito retrospettivamente nella stragrande maggioranza dei casi, ma è anche scarsamente correlato alla cronobiologia della malattia. Un recente studio ha infatti suggerito che la fase prodromica della SM possa durare, in media, circa 6 anni prima dell’esordio clinico di malattia.15 Questi dati, presi nel loro complesso, mettono in discussione il postulato tradizionale che categorizza come fattore prognostico sfavorevole l’esordio tardivo di malattia.
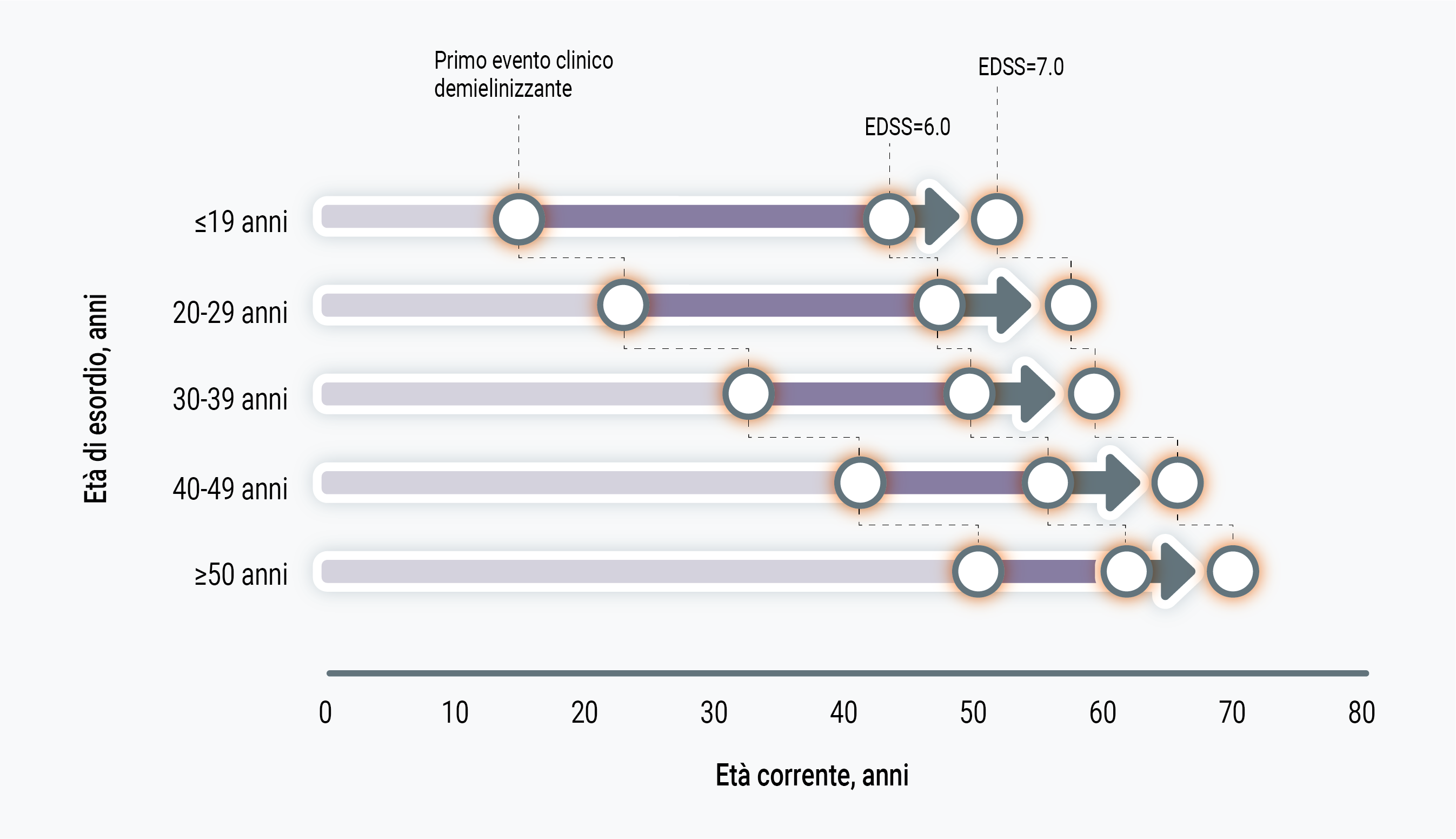
Figura 2. Età e tempo (in anni) al raggiungimento dei milestones di disabilità, stratificate per età di esordio clinico della Sclerosi Multipla: i pazienti con esordio tardivo raggiungono più rapidamente livelli avanzati di disabilità, ma ad una età superiore rispetto a coloro che hanno un esordio di malattia più precoce [modificato da 14].
Immunosenescenza e SM
Il termine immunosenescenza definisce un graduale deterioramento del sistema immunitario causato dal naturale avanzamento dell’età, dunque va considerato nel complesso come un processo fisiologico.16 Tale decadimento immunitario, infatti, si verifica in tutte le specie viventi, indipendentemente rispetto al tempo “cronologico”, ma piuttosto in relazione all’aspettativa di vita specie-specifica.
Nel corso dell’invecchiamento, il sistema immunitario subisce una serie di eventi complessi che si verificano praticamente, tutti i compartimenti, incluso quello cellulare, il microambiente degli organi linfoidi ed i fattori circolanti responsabili dell’immuno-omeostasi, quali interleuchine (IL), citochine, chemochine, etc.(Figura 3). I fenomeni legati all’immunosenescenza coinvolgono tanto l’immunità innata quanto quella adattiva, anche se quest’ultima è quella maggiormente suscettibile. In sintesi, si verificano tre fenomeni specifici:
- riduzione della risposta immunitaria e dell’immunosorveglianza in genere, con aumentato rischio di infezioni (in particolare da patogeni opportunisti) e neoplasie;
- incremento del milieu infiammatorio ed ossidativo(“oxi-inflammaging”);
- aumentata produzione di auto-anticorpi.
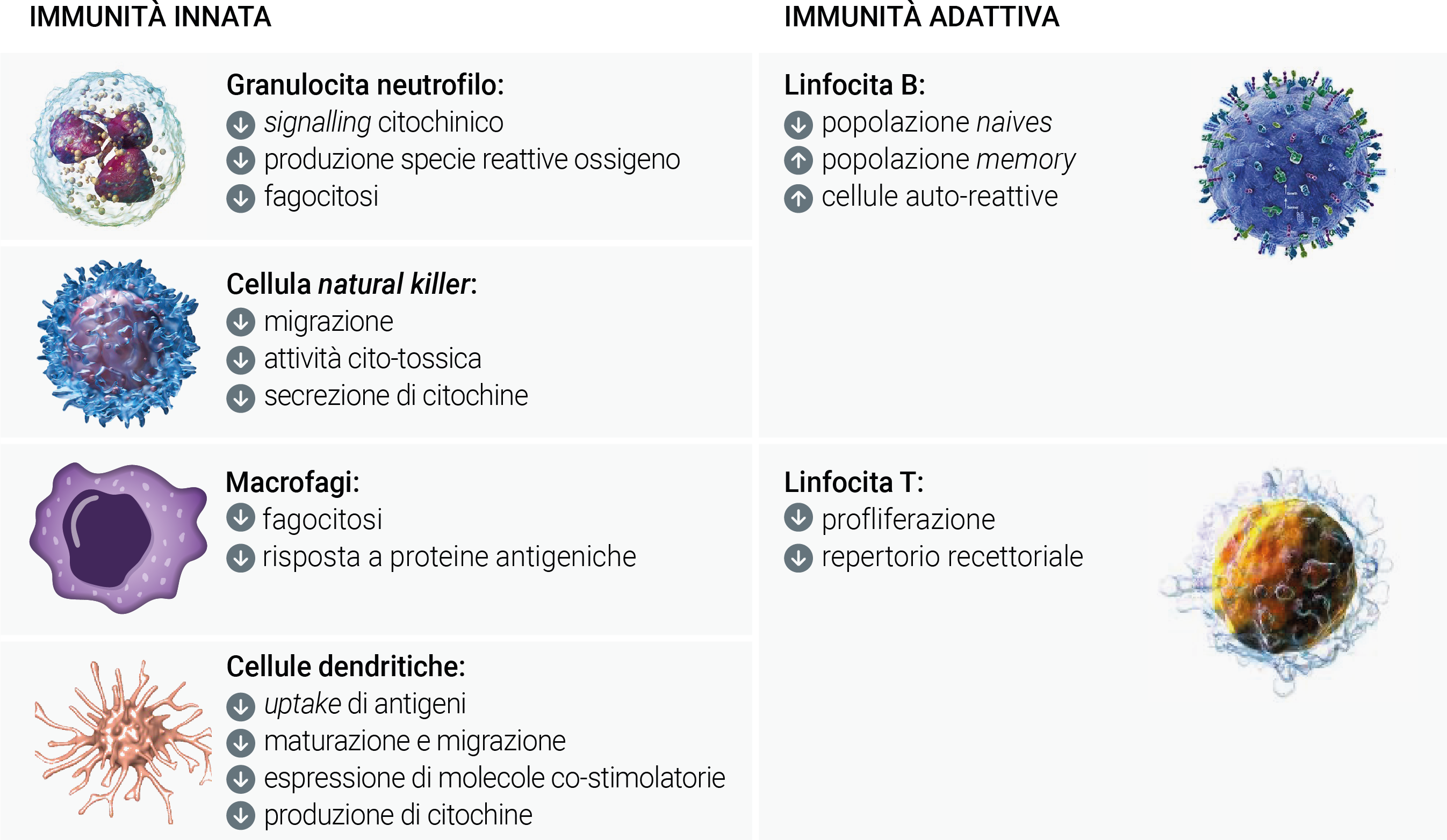
Figura 3. Effetti dell’immunosenescenza sulle cellule del sistema immunitario: tutti i compartimenti cellulari, sia quelli dell’immunità innata che adattiva, subiscono profonde modificazioni qualitative e quantitative.
Macrofagi, microglia, cellule dendritiche e granulociti neutrofili mostrano una riduzione dell’attività fagocitaria, della
chemiotassi e della migrazione in genere, mentre hanno comportamenti differenti per quanto concerne la risposta infiammatoria, debole per i macrofagi, ma al contrario esagerata per la microglia (fenomeno del cosiddetto priming della microglia).17
Si assiste ad una ridotta produzione di progenitori ematopoietici, sia a causa dell’accorciamento dei telomeri (fenomeno progressivo direttamente correlato al turn-over e all’età cronologica delle cellule somatiche in mitosi), sia per l’impoverimento del patrimonio enzimatico cellulare, sia per modificazioni epigenetiche. Le profonde trasformazioni del midollo ematopoietico hanno conseguenze anche in termini di ridotta generazione di linfociti B, a cui consegue un minore rilascio di IL-7 e ridotta capacità di switching tra isotipi o classi di immunoglobuline, mentre al contempo aumenta la produzione di auto-anticorpi e di immunoglobuline monoclonali a bassa affinità. Aumenta anche il numero di linfociti B-memoria, che però sono dotati di una ridotta diversità e affinità anticorpale.18
Mentre la citotossicità anticorpo-mediata sembra non essere influenzata in maniera rilevante dall’età, la citotossicità cellulo-mediata è compromessa dall’invecchiamento a causa di una ridotta funzionalità (ma non quantità) di cellule natural killer, baluardo importante nell’immunosorveglianza contro cellule infettate da virus e neoplasie.19
Il timo va incontro a fenomeni involutivi, con conseguente impoverimento del repertorio T-linfocitario, riduzione della conta assoluta di linfociti T CD4+ e CD8+ e minore capacità di risposta ai neo-antigeni. La ridotta disponibilità di linfociti T CD4+ si traduce in una ridotta espressione di IL-2 e CD28 che rappresentano due fattori cruciali per stimolare la risposta immunitaria, in particolare contro infezioni croniche virali sostenute da citomegalovirus (CMV) e virus di Epstein-Barr virus (EBV). Nel corso dell’invecchiamento, il compartimento T-cellulare si popola prevalentemente di linfociti T CD8+ anti-CMV e anti-EBV, tanto da essere stati proposti come biomarcatori di immunosenescenza.20
Il fenomeno noto come oxi-inflammaging consiste in uno stato di infiammazione cronica, di basso grado, asintomatica o paucisintomatica, che è in relazione ad aumentati livelli di citochine pro-infiammatorie in circolo, principalmente IL-1, IL-6 e Tumor Necrosis Factor (TNF). Si verifica, contestualmente, un incremento di radicali liberi ed una ridotta attività anti-ossidante, con conseguenze negative sul metabolismo mitocondriale e sulla membrana cellulare, inducendo uno stato di stress cronico ossidativo.21
I pazienti affetti da SM presentano fenomeni di immunosenescenza ‘accelerata’, nel senso che vanno incontro ad una più rapida involuzione timica e maggiore espansione di cloni specifici anti-CMV ed anti-EBV, riducendo la disponibilità di linfociti T-naive disponibili per la difesa contro altri agenti patogeni. La condizione di oxi-inflamaging è potenziata nei pazienti con SM che già convivono con una situazione cronica di infiammazione e stress ossidativo, come anche dimostrato da studi neuropatologici che hanno rilevato, all’interno delle placche di demielinizzazione, elevate quantità di oligodendrociti in apoptosi, lipidi ed acidi nucleici in stato di ossidazione.22
La popolazione SM “dimenticata”
La disponibilità di diversi e nuovi DMTs sta favorendo un cambiamento di paradigma nel trattamento dei pazienti con SM, con l’obiettivo di raggiungere un controllo sempre più efficace sulle ricadute e sulla progressione della disabilità. In questa prospettiva, il classico algoritmo terapeutico di escalation sta lasciando oramai spazio al cosiddetto early intensive treatment (EIT).23
Per escalation si intende l’avvio di un trattamento dotato di maggiore sicurezza, ma più modesta efficacia, con eventuale successivo passaggio a DMTs più aggressivi, anche se con profilo di sicurezza meno favorevole, in caso di mancato controllo della malattia. Tale approccio terapeutico necessita di un monitoraggio pro attivo della risposta al trattamento iniziale, argomento finora molto controverso in quanto non si è raggiunto un consensus sulla definizione di risposta ottimale alla terapia.24
L’approccio EIT è invece basato sull’avvio immediato, subito dopo la diagnosi, di un farmaco ad elevata efficacia, con l’obiettivo di raggiungere il più rapidamente possibile il controllo della malattia. Tuttavia, l’algoritmo EIT presenta notevoli criticità nella sua applicazione al paziente più anziano, a causa del fatto che non esistono dati sperimentali che permettano di stimare un attendibile rapporto rischio/beneficio dei farmaci nelle classi di età al di sopra dei 50 anni.25
Praticamente tutti i trials clinici hanno arruolato pazienti con limiti di età non superiore a 55 anni (fa eccezione solo il trial EXPAND con limite superiore di età fissato a 60 anni) e sostanzialmente privi di comorbilità, dunque popolazioni altamente selezionate e non immediatamente traslabili alle popolazioni real world afferenti ai Centri SM.
Analisi di sottogruppo e meta-analisi di dati aggregati estrapolati dai trials clinici hanno inoltre suggerito che i DMTs abbiano maggiore efficacia nelle popolazioni più giovani e più attive26, mentre la loro efficacia sulla riduzione del rischio di peggioramento della disabilità si riduce gradualmente con l’avanzare dell’età fino a non mostrare più nessun vantaggio (rispetto a placebo o comparatore) all’età di 53 anni27 (Figura 4/A).
Un’altra meta-analisi basata sui dati dei trials clinici ha stimato un aumentato rischio di neoplasie in pazienti con età superiore ai 45 anni trattati con farmaci depletivi28 (Figura 4/B).
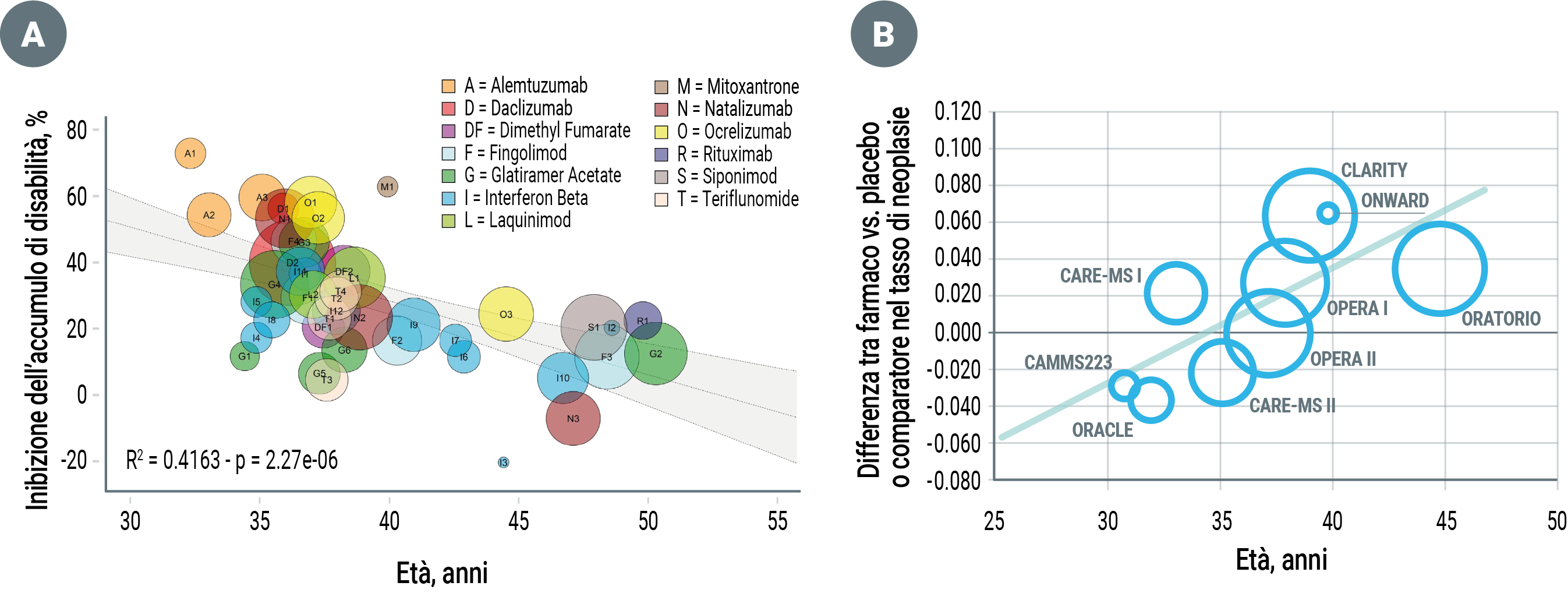
Figura 4. Meta-regressioni (bubble-plots) di dati estrapolati dai trials clinici randomizzati e controllati sui disease-modifying treatments: l’efficacia dei farmaci sull’accumulo di disabilità diminuisce con l’avanzare dell’età (A), mentre il rischio di neoplasie aumenta con l’avanzare dell’età negli studi su farmaci con effetto depletivo su linfociti B e/o T (B); ciascuna ‘bolla’ corrisponde ad un singolo trial clinico, con area proporzionale alla dimensione campionaria [modificato da 27,28].
Non bisogna poi dimenticare l’aumento delle malattie in comorbilità con l’avanzare dell’età, in particolare quelle a carico del sistema cardio-vascolare e le malattie metaboliche, con conseguente e necessario ricorso ad un approccio poli-farmacologico29 (Figura 5).
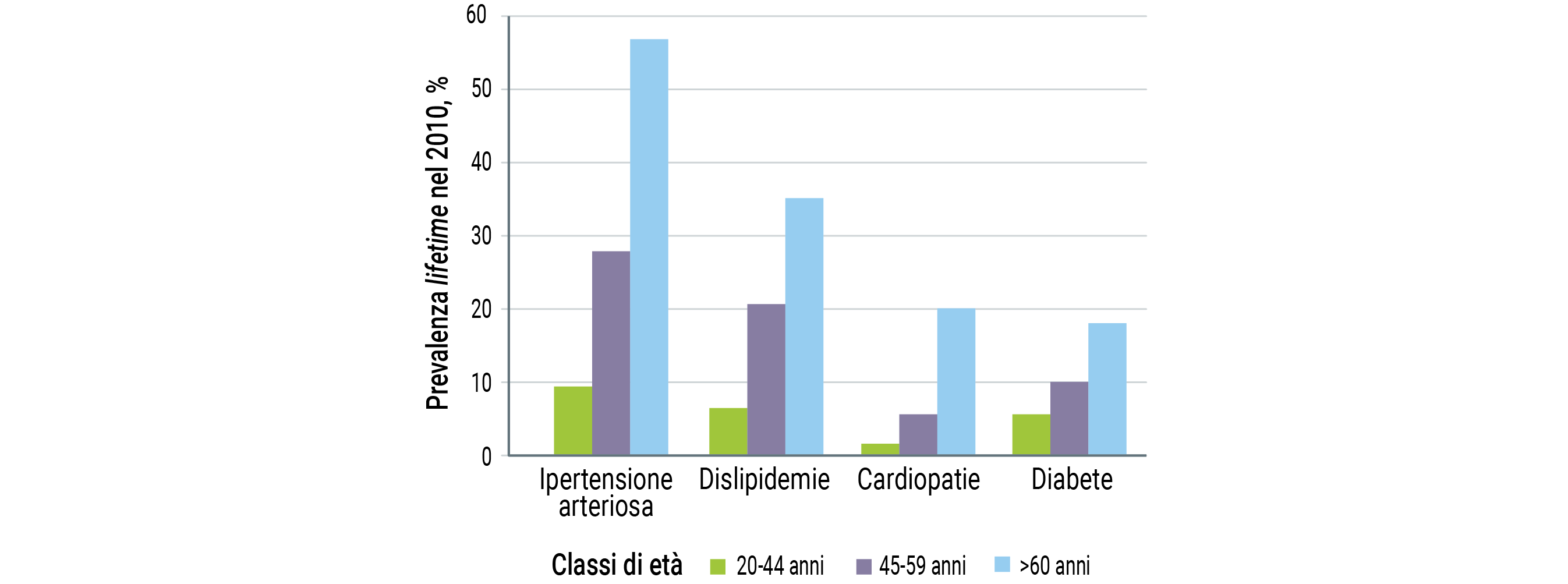
Figura 5. Prevalenza delle comorbilità più frequenti in Sclerosi Multipla, stratificata per età: le malattie cardio-vascolari sono molto più frequenti nelle classi di età più avanzata [modificato da 29].
Un altro tema rilevante è quello relativo alla sicurezza, nelle popolazioni anziane, di farmaci che hanno un profondo impatto sul sistema immunitario a causa del meccanismo d’azione depletivo sui linfociti B (ofatumumab, ocrelizumab), B e T (alemztuzumab, cladribina) oppure a causa della compartimentalizzazione dei linfociti nelle strutture linfonodali (fingolimod, ozanimod, ponesimod, siponomod) o al di fuori della barriera emato-encefalica (natalizumab). Tali effetti sul sistema immunitario, pur garantendo un efficace controllo sull’attività di malattia, espongono i pazienti ad un aumentato rischio di infezioni opportunistiche e neoplasie, specialmente se over-50.30
Non solo i farmaci utilizzati nell’algoritmo EIT, ma anche altre molecole possono essere associate allo sviluppo di linfopenia, quali dimetil fumarato e fingolimod, specialmente in pazienti che iniziano il trattamento ad un’età superiore ai 50 anni. La linfopenia è infatti uno dei meccanismi principali di sviluppo di infezioni opportunistiche, tra cui la temibile e potenzialmente fatale leucoencefalopatia multifocale progressiva (PML), causata dalla riattivazione del virus John Cunningham (JCV)31 (Tabella 1).
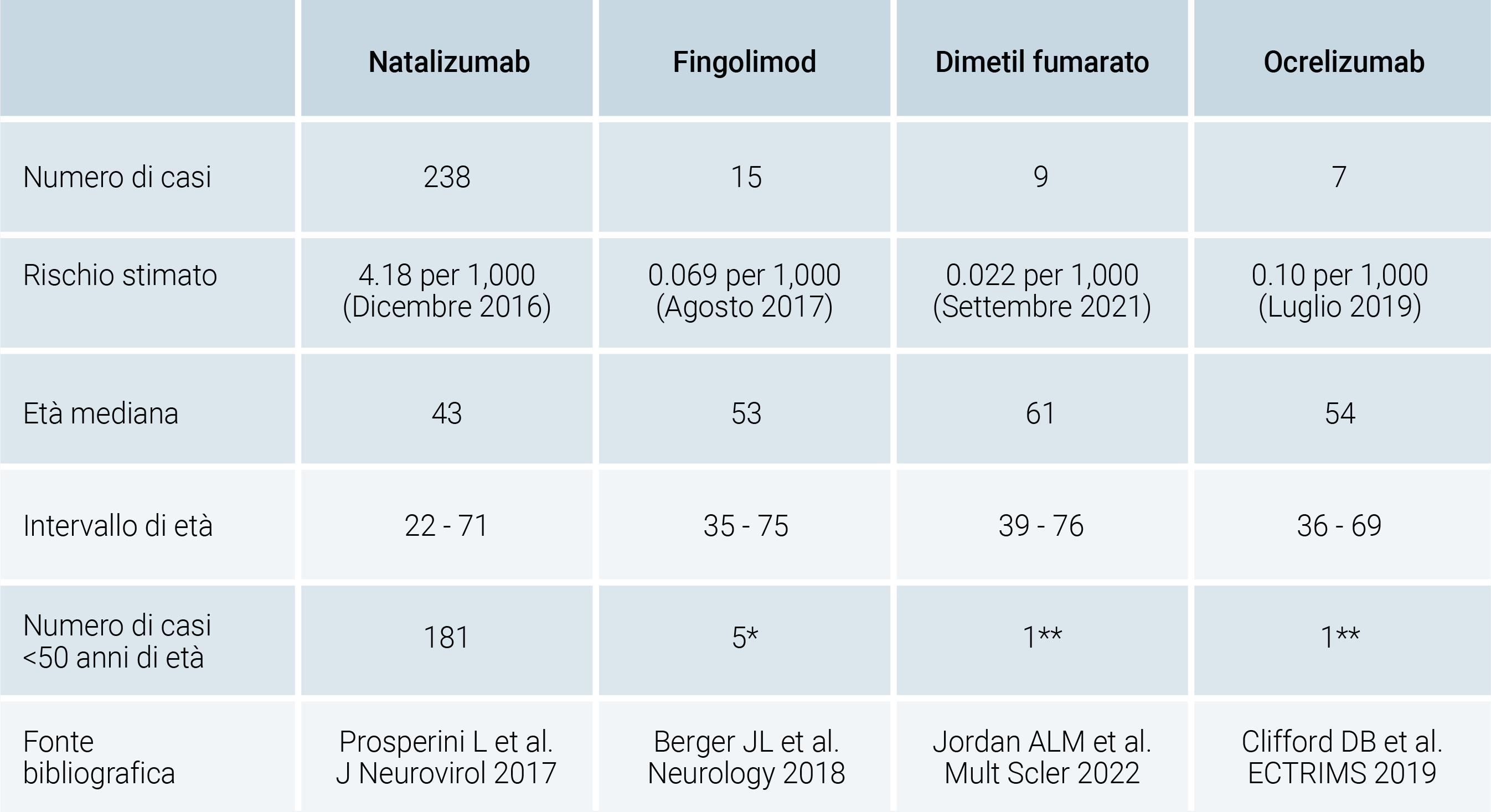
Tabella 1. Caratteristiche demografiche dei casi di Leucoencefalopatia Multifocale Progressiva in corso di disease-modifying treatments per la Sclerosi Multipla.
*nessun paziente esposto a Natalizumab nei 6 mesi precedenti
**pazienti precedentemente esposti a Natalizumab con sieropositività per John Cunningham Virus
La malattia si verifica generalmente in pazienti con compromissione dell’immunità cellulo-mediata, in particolare in corso di infezione da HIV o a seguito di immunosoppressione per procedure di trapianto; tuttavia, forme sporadiche di PML sono descritte anche nell’anziano proprio in quanto espressione di una marcata immunosenescenza. Nel contesto della SM, casi di PML si sono verificati soprattutto in corso di trattamento con natalizumab, farmaco che compromette selettivamente l’immunosorveglianza a livello del SNC, pur non producendo linfopenia. L’attuale stratificazione del rischio di PML nei pazienti trattati con natalizumab è basata sulla durata dell’esposizione al farmaco, sull’uso precedente di immunosoppressori e sulla presenza e indice anticorpale anti-JCV. Tuttavia, alcuni dati suggeriscono che anche l’età all’inizio della terapia abbia un ruolo: nello specifico, iniziare il trattamento dopo i 50 anni piuttosto che prima dei 30 anni di età comporterebbe un rischio doppio di contrarre precocemente la PML.32
Strategie terapeutiche di de-risking
Da quanto finora emerso appare evidente l’opportunità di ri-bilanciare il rapporto rischio/beneficio del trattamento nei pazienti over-50 affetti da SM. La strategia di de-risking più immediata ed agevole potrebbe contemplare l’interruzione di qualsiasi DMT, specialmente nei pazienti stabili da molti anni, ma ad oggi non ci sono dati evidence-based circa il rischio di riattivazione di malattia a seguito di una interruzione permanente del trattamento.33 Al momento sono stati disegnati tre studi clinici randomizzati e controllati con l’obiettivo di rispondere a tale quesito: DISCOMS, STOP-I-SEP e DOT-MS (Tabella 2).
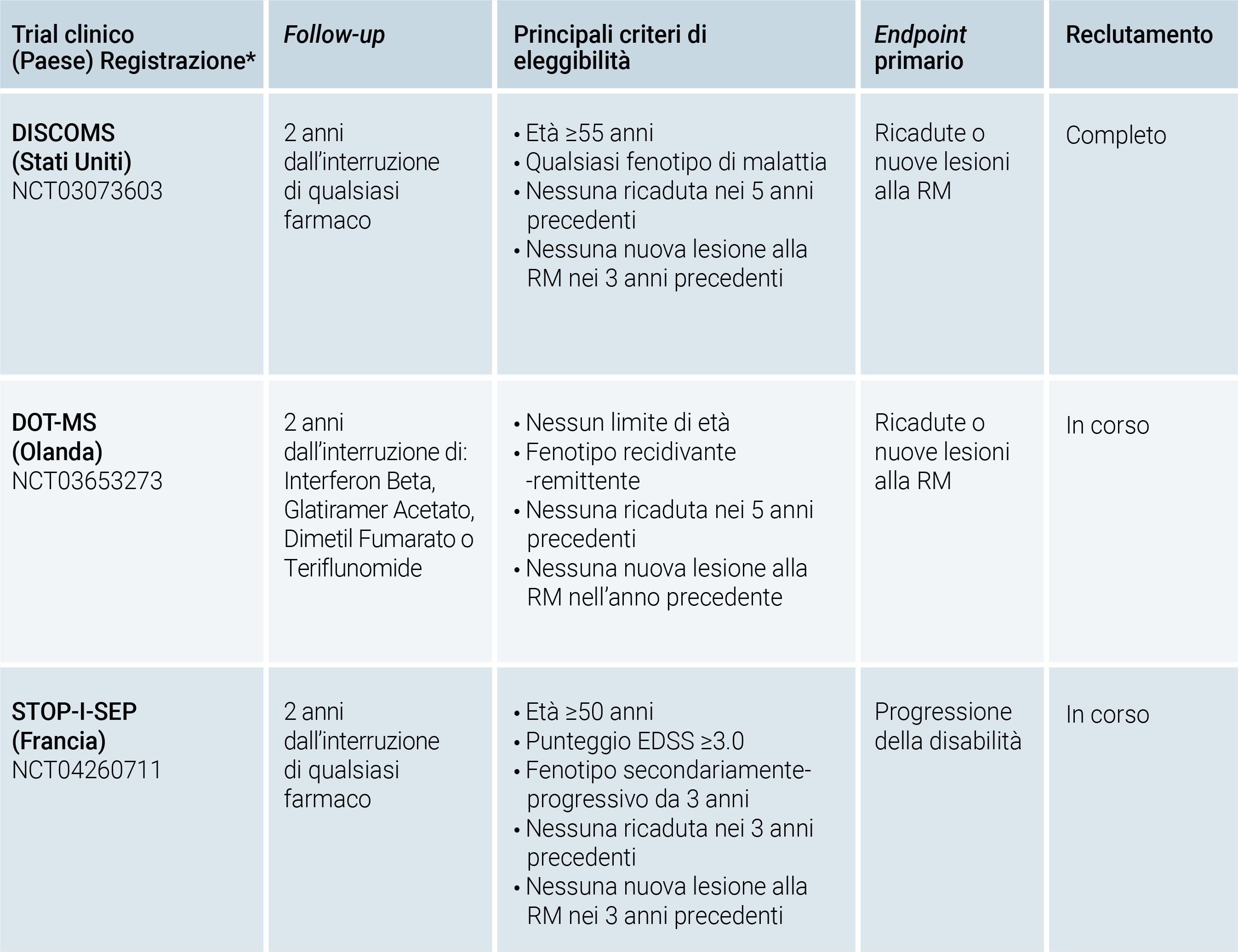
Tabella 2. Overview dei trials clinici disegnati per esplorare l’effetto dell’interruzione permanente dei disease-modifying treatments per la Sclerosi Multipla in pazienti stabili.
*www.clinicaltrials.gov
In tutti e tre gli studi, pur con le rispettive differenze, il disegno prevede la randomizzazione a due gruppi, uno che interrompe il trattamento, l’altro che lo prosegue. Gli studi STOP-I-SEP e DOT-MS sono ancora in fase di arruolamento, mentre lo studio DISCOMS è terminato di recente. Lo studio DISCOMS ha fornito risultati contrastanti che, per certi versi, scoraggiano l’interruzione del trattamento anche di farmaci a moderata efficacia e nonostante una lunga fase di stabilità di malattia e l’età avanzata (sono stati arruolati pazienti con età >55 anni).34
L’outcome primario (proporzione di pazienti con ricaduta o con nuove lesioni alla RM encefalo nei 24 mesi di follow-up) è stato raggiunto da 16 su 131 (12.2%) pazienti dopo l’interruzione rispetto a 6 su 128 (4.7%) che sono stati randomizzati a continuare la loro DMT, un risultato che non riesce a dimostrare, dal punto di vista statistico, la non inferiorità di interrompere rispetto a continuare il trattamento.
Alla luce di quanto sopra riportato, appare ad oggi appropriato mettere in atto strategie di mitigazione del rischio piuttosto che considerare l’interruzione permanente dei DMTs, anche alla luce del fatto che i fenomeni di progressione della disabilità indipendenti dalle ricadute (PIRA) sono più frequenti con l’avanzare dell’età, ma che al contempo una prolungata esposizione ai DMTs (intesa come proporzione di anni di malattia in cui il paziente è stato trattato con uno o più farmaci) rappresenterebbe un fattore protettivo nei confronti di fenomeni PIRA.35
Tra le strategie di de-risking, oltre a quelle più lampanti legate alla de-escalation da DMTs che presentano safety concerns legati principalmente al rischio di infezioni opportunistiche e linfopenia (modulatori dei recettori delle sfingosine, natalizumab, ocrelizumab, dimetil fumarato), possiamo annoverare alcune esperienze sperimentali di “diluizione” delle dosi o degli intervalli di somministrazione di alcuni farmaci (fingolimod e dimetil fumarato).36-38 Si deve tuttavia sottolineare che tali approcci non possono essere traslati direttamente nella pratica clinica, in quanto in discordanza con la scheda tecnica dei farmaci, ad eccezione della dose estesa di natalizumab.39
Ovviamente qualsiasi strategia di de-risking va attentamente valutata, soprattutto con farmaci ad elevata efficacia e con meccanismo d’azione sul traffico linfocitario (Natalizumab e modulatori dei recettori delle sfingosine), onde evitare una marcata e difficilmente controllabile riattivazione di malattia, che in alcuni casi è stata definita tale da configuare un rebound di malattia.40
Interferon Beta: farmaco antico, prospettive moderne
Una strategia di de-risking ragionata può prevedere l’utilizzo di farmaci che abbiano profili di sicurezza più vantaggiosi, quali teriflunomide, glatiramer acetato o interferon beta.
Teriflunomide è un farmaco molto utilizzato nella popolazione SM più anziana41, ma bisogna considerare che tra gli eventi avversi sono riportati ipertensione arteriosa e neuropatie periferiche, due condizioni molto frequenti nelle classi di età più avanzate anche nella popolazione generale.42
Glatiramer acetato è un’opzione che può presentare minori rischi di eventi avversi correlati all’età, ma interferon beta appare una soluzione più vantaggiosa per svariati motivi. Innanzitutto, l’effetto protettivo di interferon beta, soprattutto a livello delle infezioni respiratorie, è studiato da diversi anni43, come tra l’altro riportato in un consensus paper nazionale sulla gestione del rischio infettivo44. Il dato più sorprendente è quello relativo alla sopravvivenza: una analisi di estensione del trial registrativo di Interferon Beta-1b ha documentato una riduzione di circa il 47% del rischio di mortalità rispetto ai pazienti originariamente assegnati a placebo45 (Figura 6).
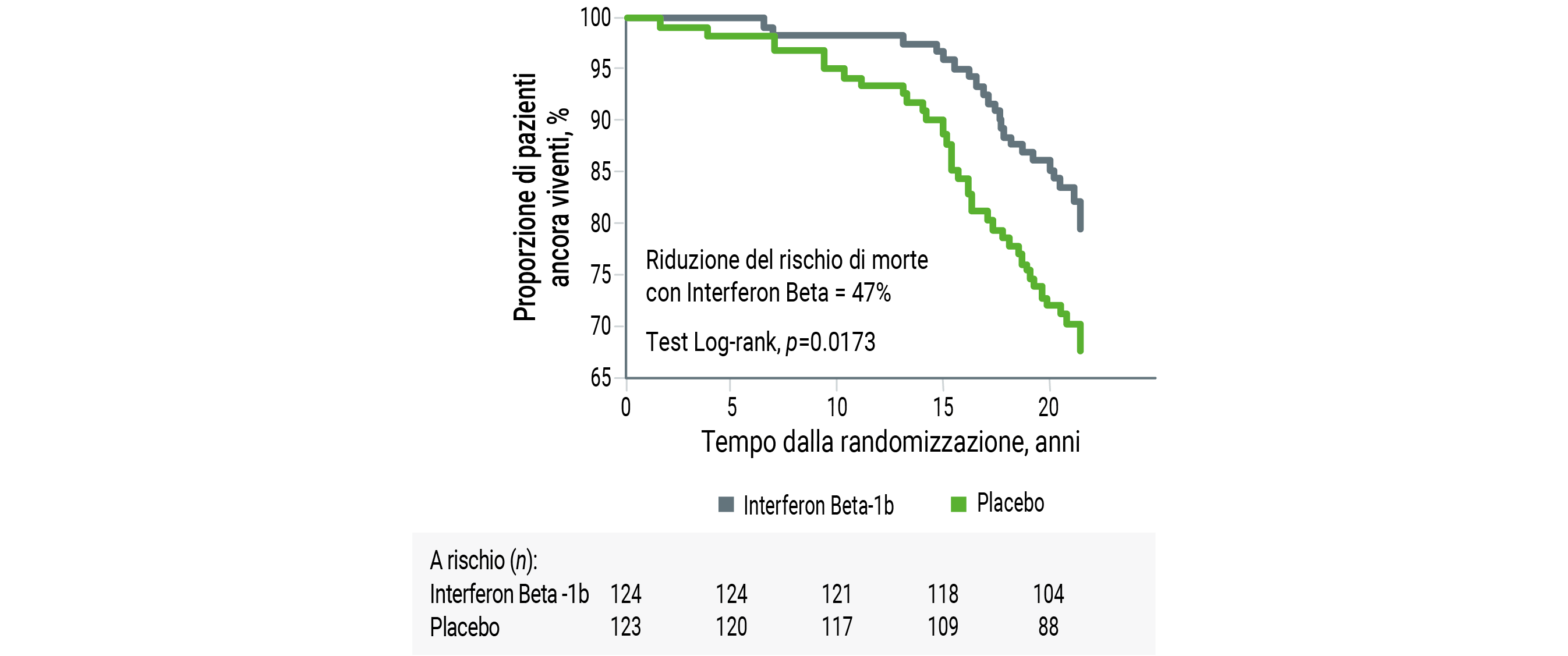
Figura 6. Curva di sopravvivenza per il rischio di morte dopo randomizzazione a Interferon Beta-1b o placebo: i pazienti originariamente allocati al trattamento attivo hanno avuto un beneficio significativo in termini di sopravvivenza rispetto al gruppo placebo dopo un follow-up di 21 anni [modificato da 45].
Tale dato è stato successivamente confermato anche dai dati di due popolazioni indipendenti, British Columbia (Canada) e Rennes (Francia), nelle quali sono stati osservati:
- una riduzione della mortalità del 32% tra esposti e non esposti ad interferon beta;
- una correlazione diretta tra sopravvivenza ed esposizione >3 anni all’interferon beta;
- un sostanziale vantaggio della terapia con interferon beta indipendente dalla precocità di assunzione, ovverosia un effetto favorevole sulla sopravvivenza sia in pazienti che iniziano il farmaco dopo i 40 anni di età e/o dopo 5 anni di durata di malattia.46
Uno dei meccanismi plausibili del vantaggio di interferon beta-1b in termini di sopravvivenza potrebbe essere riconducibile al suo effetto anti-virale, che comporterebbe una riduzione del rischio di infezioni respiratorie gravi11,47. Altri dati rilevanti che supportano la scelta di interferon beta-1b sono anche quelli relativi all’efficacia a lungo termine del farmaco sulle disfunzioni cognitive48 (Figura 7), il minimo burden del monitoraggio del trattamento49, la compatibilità con qualsiasi tipo di vaccinazione50, la possibilità di assunzione durante gravidanza e allattamento51, la rimborsabilità anche nelle forme secondariamente-progressive.
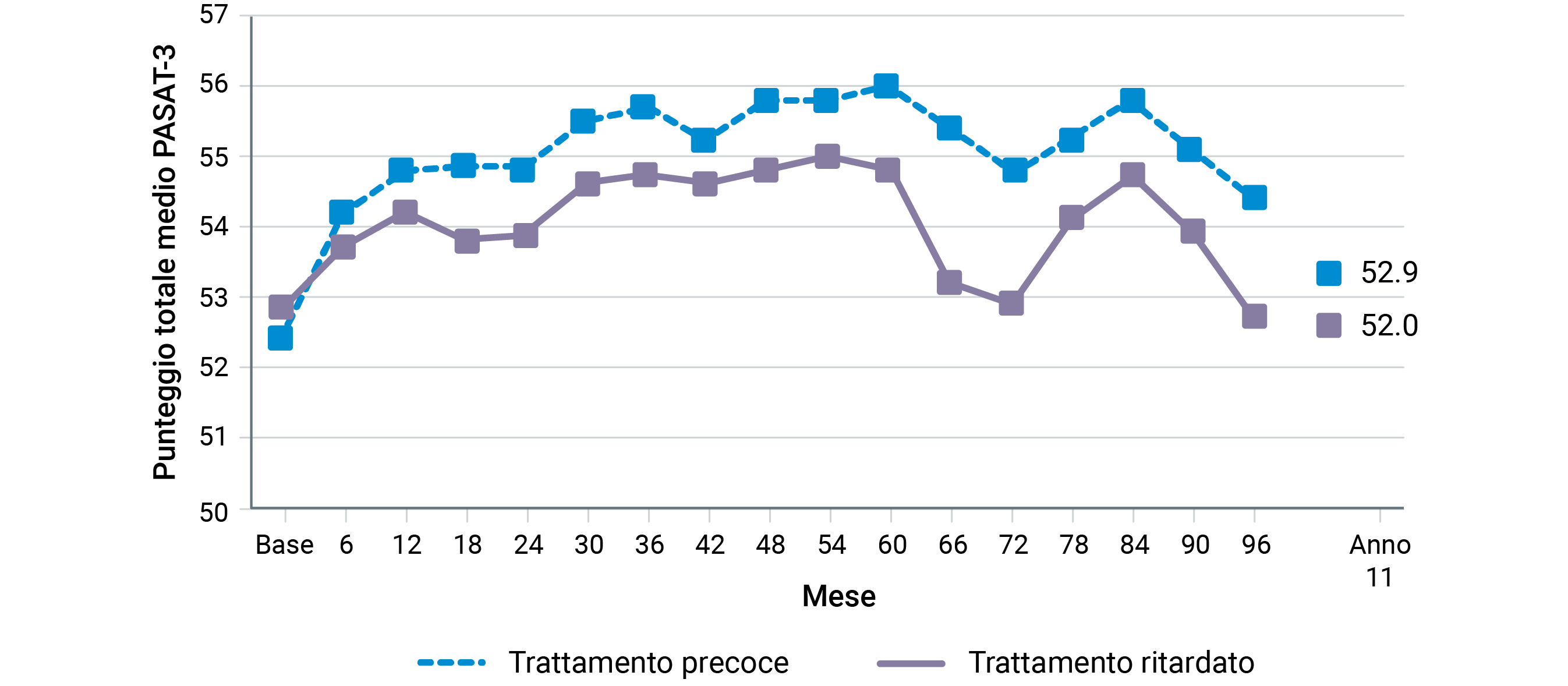
Figura 7. Punteggi ottenuti al Paced Auditory Serial Addition Task (PASAT 3”) in pazienti al primo evento demielinizzante originariamente randomizzati a interferon beta-1b o placebo: il beneficio sulle funzioni cognitive del trattamento attivo rispetto al placebo è presente durante tutto il follow-up di 11 anni [modificato da 48].
Al contrario, altri DMTs, in particolare quelli dotati di proprietà immunosoppressive, possono indurre fenomeni di immunosenescenza precoce nei pazienti con SM, sebbene i meccanismi dietro a questo processo non siano ancora del tutto noti. In un recente studio condotto su 122 pazienti con SM trattati con 4 diversi DMTs, tra cui interferon beta, è stato valutato se e quali DMTs fossero in grado di indurre modifiche al sistema immunitario tali da accelerare fenomeni di immunosenescenza.52 Sono stati misurati, prima della terapia e a 6 e 12 mesi di trattamento, due marcatori di senescenza (T-cell receptor excision circles, TRECs e K-deleting recombination excision circles, KRECs), la cui quantità è legata allo stato di maturazione delle cellule T e B.
Queste molecole sono contenute nei linfociti T e B naives rilasciati dal timo e dal midollo osseo e sono considerati marcatori molecolari di senescenza. Nei pazienti naives alla terapia, è stata osservata una correlazione significativa, per cui all’avanzare dell’età diminuiva il numero di cellule T e B di nuova produzione. Sebbene i DMTs abbiano indotto diversi cambiamenti (sia aumenti che diminuzioni) nella produzione di linfociti T e B naives, 12 mesi di trattamento con interferon beta non hanno inciso sulla correlazione tra il rilascio di linfociti contenenti TREC o KREC e l’età (dato riscontrato al basale) al contrario delle altre molecole in studio.52 Questo risultato suggerisce che DMTs quali alemtuzumab e fingolimod, pur esercitando effetti immunosoppressivi selettivi, possano indurre profondi cambiamenti nel sistema immunitario che nel lungo termine rischiano di tradursi in eventi avversi difficilmente “catturabili” dai trials clinici a causa della loro lunga latenza di occorrenza.
Conclusioni
Negli ultimi anni stiamo assistendo ad una “transizione” epidemiologica da una popolazione di giovani ad una popolazione di adulti-anziani con SM, fenomeno che impatta profondamente sul rapporto rischio/beneficio dei DMTs attualmente disponibili. Comorbilità e immunosenescenza, due variabili fondamentali nella scelta della corretta strategia terapeutica, devono essere considerate molto più spesso che in passato. Nei pazienti over-50, i farmaci che esercitano un profondo impatto sul sistema immunitario possono essere controproducenti dal punto di vista della safety e, per quanto è emerso finora, sembrano offrire poco o nulla in termini di efficacia. In questo scenario, interferon beta-1b può rappresentare il giusto compromesso tra la necessità di un trattamento long-lasting e l’importanza di tutelare la sicurezza di un paziente che va incontro ai complessi processi di invecchiamento.


Lascia un commento