Introduzione
Il caso clinico proposto rappresenta un esempio della gestione della malattia renale diabetica (DKD) come da linee guida Kidney Disease: Improving Globall Outcomes (KDIGO) 2024 e si propone di valutare gli effetti della terapia con Finerenone dopo un anno di follow-up, in un paziente già in trattamento con RAS-inibitori ed SGLT2-inibitori.
Malattia renale cronica associata a Diabete Mellito
Definizione
La nefropatia diabetica è il termine usato per esprimere il danno renale determinato dal diabete mellito. La definizione di nefropatia diabetica non può prescindere da una valutazione istologica che ne documenti le alterazioni renali. Di conseguenza, si può parlare di nefropatia diabetica solo dopo aver eseguito una biopsia renale. Nella pratica clinica, in assenza di un referto bioptico, si usa parlare di “malattia renale cronica associata a diabete mellito”, quando, in presenza di una lunga storia di diabete mellito, sia presente albuminuria persistente e/o riduzione del Glomerular Filtration Rate (GFR).
Patogenesi
Un ruolo importante nella patogenesi della nefropatia diabetica è svolto dall’alterazione del feedback tubuloglomerulare: l’iperglicemia conduce a glicosuria, il glucosio filtrato viene maggiormente riassorbito, attraverso i cotrasportatori SGLT2, insieme al sodio, che arriverà, quindi, in minor quantità a livello distale, con mancata attivazione della macula densa, vasodilatazione dell’arteriola afferente e iperfiltrazione glomerulare. Seguono lo stress capillare, il danno ossidativo, comparsa di albuminuria ed evoluzione fibrotica cronica, amplificati anche dalla formazione dei prodotti di glicosilazione avanzata (AGEs).
Clinica
La malattia renale cronica associata a diabete è tipicamente asintomatica. Pertanto, la valutazione clinica si basa prevalentemente sul dosaggio periodico di creatininemia (con stima del GFR) e albuminuria, utili nel follow up, ma anche nello screening in soggetti diabetici, come suggerito dalle linee guida ADA (American Diabetes Association) e KDIGO 2024.1,2
La storia naturale della patologia è caratterizzata da una prima fase di iperfiltrazione glomerulare (quindi GFR normale o aumentato) e una seconda fase di danno renale con riduzione del GFR e comparsa di albuminuria. Per questo, l’albuminuria A2 resta il più precoce biomarcatore clinico-prognostico che sottende le modificazioni microvascolari renali ed è associata a progressione verso un’albuminuria A3 e riduzione del GFR3,4mentre un’albuminuria A3 è indicatore prognostico di maggior rischio di ESKD ed eventi cardiovascolari.5-7 L’entità dell’albuminuria è estremamente variabile: in casi severi può superare la soglia di 3,5 g/24h configurando il quadro di sindrome nefrosica8,9, ma è anche possibile una regressione dell’albuminuria, soprattutto in presenza di un ottimale controllo glicemico, pressorio e lipidico, con conseguente riduzione del rischio di End-Stage Kidney Disease (ESKD).10
Il naturale declino del GFR determinato dalla senescenza renale, in soggetti sani, è di circa 1 mL/min/anno11, mentre è più rapido nei soggetti con nefropatia diabetica (>3 mL/min/anno), soprattutto con storia di diabete da oltre 10 anni e/o retinopatia, albuminuria A3 e GFR basale <60 mL/min/1,73 m2.12-16 Il rapido declino del GFR si registra indipendentemente dalla regressione o meno dell’albuminuria17,18, tuttavia, sembra essere di minor entità in soggetti normoalbuminurici.19-23
Pertanto, l’albuminuria e il declino del GFR sono fattori indipendenti e addizionali che condizionano il rischio di eventi cardiovascolari e maggior mortalità.5,24-27
Diagnosi
La diagnosi di nefropatia diabetica si basa su reperti istologici valutati con biopsia renale.
Secondo la classificazione di Renal Pathology Society28 la nefropatia diabetica è definita come:
- Classe I: assottigliamento isolato della membrana basale glomerulare (<430 nm nei maschi e <395 nm nelle femmine);
- Classe II: espansione mesangiale lieve (IIa) se l’area di espansione è <25% del totale del mesangio o severa (IIb) se >25%;
- Classe III: almeno un nodulo di Kimmelstiel-Wilson (glomerulosclerosi nodulare intercapillare) o glomerulosclerosi <50%;
- Classe IV: glomerulosclerosi >50%.
Sono comuni anche la ialinosi arteriolare, l’arteriosclerosi29 e la fibrosi tubulointerstiziale che compare dopo le alterazioni glomerulari ed è indice di patologia avanzata associata a maggior rischio di ESKD.29-31 Nonostante la diagnosi di nefropatia diabetica sia istologica, nella pratica clinica è più comune effettuare una diagnosi clinica presunta (senza praticare biopsia), che si basa sulla presenza di:
- lunga durata del diabete e/o retinopatia diabetica;
- albuminuria persistente e/o riduzione del GFR persistente;
- esclusione di altre cause di nefropatia.
La durata del diabete (almeno 5 anni) è un criterio necessario affinché si possano rendere manifesti i danni renali dopo la prima fase di iperfiltrazione glomerulare, per esposizione al prediabete e all’iperglicemia.32 Inoltre, in presenza di retinopatia diabetica proliferativa si presume la concomitanza di altre complicanze microvascolari diabetiche, come quelle glomerulari.33
Per quanto riguarda l’albuminuria, a causa della grande variabilità intraindividuale dell’escrezione di albumina, dovuta a vari fattori (controllo glicemico, esercizio fisico, infezioni delle vie urinarie (IVU), elevato intake proteico)34, la diagnosi clinica si basa sulla valutazione dell’albuminuria presente in almeno due su tre campioni ottenuti nell’arco di almeno tre mesi.35 Un’albuminuria di grado A3 si presenta solitamente con una storia di diabete di almeno 10 anni o in presenza di scarso controllo glicemico (Hb glicata >9%).8 È possibile riscontrare proteinuria nel range nefrosico quando la storia di diabete supera 10-15 anni.8 Il GFR è convenzionalmente definito ridotto quando è inferiore a 60 mL/min/1,73 m2.
Per escludere altre cause di nefropatia, risulta rilevante la valutazione del sedimento urinario. In soggetti con nefropatia diabetica, in presenza di albuminuria severa, si può riscontrare anche microematuria al sedimento36,37, mentre la presenza di globuli rossi dismorfici o cilindri di emazie è reperto non comune nella nefropatia diabetica e che dovrebbe porre il sospetto di altre ipotesi diagnostiche.38 Inoltre, un’albuminuria A3 insorta nei primi 5 anni dall’insorgenza di diabete o un GFR decline > 5 mL/min/anno suggeriscono di valutare eziologie alternative.
Trattamento
Le linee guida più recenti per la gestione della nefropatia diabetica sono le linee guida KDIGO 2024, che condividono alcuni principi generali del trattamento della malattia renale cronica, tra cui:
- modifiche dello stile di vita (perseguendo un controllo ottimale del peso corporeo, una dieta salutare, la pratica di attività fisica regolare ed eliminando l’eventuale abitudine tabagica);
- controllo della pressione arteriosa, della glicemia e della dislipidemia;
- eventuale gestione di anemia, acidosi ed anomalie elettrolitiche.
Inoltre, sono oggi disponibili e indicati anche farmaci che hanno un dimostrato effetto anti-albuminurico nonché nefroprotettivo e cardioprotettivo: sistema renina-angiotensina (RAS)-inibitori, Sodium-Glucose Linked Transporter 2 (SGLT2)-inibitori, Non-Steroidal Mineralcorticoid Receptor Antagonist (ns-MRA), analoghi Glucagon-like Peptide-1 (GLP-1).
In particolare, la nefroprotezione e cardioprotezione si esplicano nella riduzione del rischio di ESKD, dialisi e morte renale, e di eventi cardiovascolari fatali e non fatali, nonché nella prevenzione del peggioramento dello scompenso cardiaco e nella riduzione dell’ospedalizzazione e mortalità da tutte le cause.
I RAS-inibitori (ACE-i o ARBs) hanno un ruolo, oltre che antipertensivo, anche anti-proteinurico e, attraverso la riduzione della caduta del filtrato, anche nefroprotettivo. Non sono state dimostrate differenze significative nell’utilizzo di ACE-i o ARBs.39-41 È noto, inoltre, che l’utilizzo combinato di ACE-i + ARBs, così come l’associazione con Aliskiren (inibitore diretto della renina), non apporta migliori risultati in termini di riduzione del rischio di progressione della malattia renale cronica, rispetto alla monoterapia, e aumenta il rischio di effetti collaterali (iperkaliemia e insufficienza renale acuta).42,43
Per quanto riguarda gli SGLT2-i, non si limitano solo al miglioramento del controllo glicemico (inducendo glicosuria), ma agiscono anche sulla correzione dell’iperfiltrazione glomerulare, determinando natriuresi e ripristinando il funzionamento del feedback tubulo glomerulare.44 I maggiori rischi da considerare sono le infezioni uro-genitali, prevenibili con adeguate norme di igiene intima.
Il Finerenone è un antagonista non steroideo del recettore dei mineralcorticoidi che ha effetti antinfiammatori e antifibrotici.45 Rispetto agli antagonisti steroidei, il Finerenone non è gravato dalla numerosità degli effetti collaterali di tipo ormonale ed è caratterizzato da un rischio di iperkaliemia di minore entità.46
I GLP-1 Agonists sono particolarmente indicati in caso di obesità, insulino-resistenza, diabete scompensato (Hb glicata >7%), GFR <45 mL/min/1,73 m2. Per gli effetti collaterali gastrointestinali sono controindicati in pazienti con pancreatite, neoplasia endocrina multipla (MEN) e soggetti sottopeso.
Nell’utilizzo di queste diverse categorie di farmaci è da ricordare che un incremento di circa il 30% del valore di creatininemia rispetto al basale, che poi si stabilizza nell’arco del primo/secondo mese di terapia, è considerato accettabile ed è un effetto atteso che non richiede sospensione del trattamento o cambi di dosaggio.47
Recentemente è stato pubblicato il trial clinico randomizzato CONFIDENCE che valutava l’utilizzo dell’associazione di più di un farmaco nefroprotettivo. Dallo studio è emerso che l’utilizzo di terapia combinata Finerenone ed Empagliflozin sia più efficace della monoterapia con solo Finerenone o solo Empagliflozin in termini di riduzione dell’albuminuria, risultata del 32% col Finerenone, del 18% con Empagliflozin e del 52% con l’associazione dei due.48
Il seguente caso clinico valuta l’utilizzo del Finerenone inserito in terapia dopo tre anni di trattamento nefroprotettivo con RAS-inibitori ed SGLT2-inibitore.
Caso clinico: esperienza in real life dell’utilizzo del Finerenone nella malattia renale diabetica
Il paziente è seguito dal 2021 presso il reparto di Nefrologia e Dialisi dell’AOU L. Vanvitelli, ed è attualmente ancora in follow up nefrologico. Il seguente articolo pone l’attenzione sulla valutazione dei risultati terapeutici ottenuti nell’ultimo anno (2024-2025) con l’utilizzo del Finerenone.
Caratteristiche del paziente all’ingresso (dati del 2021)
Sesso: maschio; Età: 70 anni; Durata del diabete: 16 anni; Primo riscontro di malattia renale: 02/02/2021; Comorbidità significative presenti: Ipertensione arteriosa, dislipidemia; Elementi in ingresso (inclusi GFR e ACR):
- Prima visita (ottobre 2021): GFR 44 mL/min/1,73 m2, proteinuria 3,77 g/24h, albuminuria 2,775 g/24h;
Fattori di rischio cardiovascolari:
- Ipertensione arteriosa dal 2009 (età 59 anni);
- Diabete mellito di tipo 2 dal 2009 (età 59 anni);
- Dislipidemia;
- Ateromasia biforcazione carotidea e carotide comune sinistra.
Inquadramento renale:
- Dall’anamnesi familiare si segnala che due fratelli presentano insufficienza renale terminale, di cui uno ha ricevuto trapianto renale, e un altro è in emodialisi;
- Primo dato di creatininemia è risalente al 2021 (1,47 mg/dL; cui corrispondeva un GFR di 50 mL/min/1,73 m2);
- Primo dato di proteinuria disponibile è risalente al 2021 con la costante positività al dipstick per albuminuria (100 mg/dL) e confermato dalla raccolta delle urine delle 24h che mostrava proteinuria di 3,77 g e albuminuria di 2,77 g;
- Presenza di rari globuli rossi al sedimento urinario;
- Profilo pressorio non dipping in base all’Holter pressorio effettuato a dicembre 2021;
- All’ecografia dell’addome completo del 2021: rene dx 90 mm DL, rene sx 92 mm DL, rapporto cortico-midollare inferiore alla norma come da note di IRC e assenza di patologie ostruttive delle vie urinarie.
Diagnosi
Il riscontro di reni già ipoplasici, con scarso rapporto cortico-midollare, è stato interpretato come un segno di cronicità della malattia renale che, in relazione alla lunga durata del diabete e sulla base anche del riscontro di ridotto GFR, proteinuria e albuminuria persistente (di grado A3) con microematuria, ha fatto concludere per una diagnosi clinica di malattia renale diabetica.
Prognosi
Date le caratteristiche clinico-anamnestiche, laboratoristiche e strumentali, il paziente è stato valutato come un soggetto ad alto rischio cardiovascolare e ad alto rischio di progressione della malattia renale (con alto rischio di ESKD, di dialisi e morte).49,5-7
Terapia
In anamnesi farmacologica il paziente assumeva: Pantoprazolo 20 mg 1 cp/die, Manidipina 20 ½ cp/die, Valsartan 40 mg 1 cp/die, Calcitriolo 0,5 mcg 1 cp/die, Alfuzosina 10 mg 1 cp/die, Allopurinolo 300 mg ½ cp/die, Atorvastatina 10 mg 1 cp/die.
Per la gestione terapeutica della malattia renale diabetica, si è scelto di utilizzare uno ad uno i pilastri della terapia di nefroprotezione: RAS-inibitori + SGLT2-inibitori + ns-MRA.
La prima strategia terapeutica adottata è stata quella di aumentare il dosaggio del Valsartan a 80 mg (massima dose clinicamente tollerata). Un SGLT2-inibitore è stato introdotto dal diabetologo nel 2021 (Empagliflozin 10 mg). Infine, data la presenza di malattia renale progressiva e un nuovo incremento di proteinuria e albuminuria nonostante terapia con RAS-inibitori ed SGLT2-inibitori, il passo successivo sarebbe stato quello di introdurre il Finerenone 10 mg/die per poi successivamente titolarlo a 20 mg/die.
Intolleranze farmacologiche e problemi di compliance Dai dati anamnestici era emerso un rialzo di creatininemia acuto nel 2019 dopo assunzione di Fenofibrato, e risoltosi con sospensione del farmaco; per cui si era deciso di non introdurre più in terapia il Fenofibrato per il controllo lipidico.
Si ritiene che questo precedente possa aver innescato sentimenti di scetticismo e sfiducia che abbiano minato la compliance di questo paziente, con comparsa di timore nei confronti di qualsiasi farmaco comporti un rialzo di creatininemia, seppur atteso.
Il paziente è noto, infatti, per la scarsa compliance alle terapie:
- segue in maniera discontinua la terapia ipolipemizzante alternandola con integratori;
- ha reso manifesti i suoi dubbi nei confronti di nuovi farmaci introdotti di volta in volta in terapia (ad esempio, richiedendo, durante la prima visita nefrologica, importanti rassicurazioni sull’adeguatezza dell’Empagliflozin introdotto in terapia dal diabetologo nel 2021);
- mostrerà nel 2024 perplessità anche sul Finerenone.
Storia clinica negli anni 2021-2024
Da ottobre 2021 a giugno 2023, grazie alla terapia con RAS-inibitori ed SGLT2-inibitori il paziente ha mostrato un notevole miglioramento dei parametri laboratoristici, arrivando a mostrare alla raccolta delle urine delle 24h una proteinuria di 1,14 g/24h e un’albuminuria di 0,74 g/24h. Tuttavia, a partire da giugno 2023, nei successivi follow-up, si è registrato un progressivo peggioramento dei parametri suddetti, fino a giugno 2024, data in cui si riscontravano: GFR 31 mL/min/1,73 m2, proteinuria 2,04 g/24h, albuminuria 1,1 g/24h. Seguendo le linee guida KDIGO 2024, è stato scelto il Finerenone per far fronte ad un nuovo incremento di proteinuria e albuminuria comparso nonostante la terapia con RAS-inibitori ed SGLT2-inibitori. Inoltre, l’introduzione del Finerenone è stata ponderata, oltre che per gli outcomes renali di proteinuria e albuminuria, anche per i suoi effetti cardioprotettivi e nefroprotettivi, per cui risulta particolarmente indicato in un paziente ad alto rischio cardiovascolare e renale, e tenendo conto dei valori del K+ sierico di 4,5 mEq/L che ne consentivano l’introduzione in terapia.
Purtroppo, questa scelta terapeutica non è stata inizialmente ben accolta dal paziente, che ha dichiarato apertamente il suo timore di reazioni avverse e i suoi dubbi sull’efficacia del farmaco. Questo ha determinato un ritardo dell’introduzione del Finerenone di mesi interi rispetto a quanto da noi proposto.
La sfida intrapresa è stata quella di rendere il paziente compliante alla terapia con Finerenone con due obiettivi principali:
- ottenere una riduzione della proteinuria e dell’albuminuria;
- rallentare la progressione dell’insufficienza renale.
Storia clinica nell’anno 2024-2025
Sono stati utilizzati diversi approcci per migliorare la compliance di questo paziente, tra cui: l’utilizzo di una comunicazione efficace, la valutazione del bilancio rischio-beneficio ponderando i vantaggi e gli svantaggi della terapia con Finerenone insieme al paziente, lasciando sempre e comunque spazio al suo libero arbitrio, affinché potesse effettuare una scelta con piena consapevolezza e cognizione di causa.
Alla visita di giugno 2024 si riscontravano: GFR 31 mL/min/1,73 m2, proteinuria 2,04 g/24h, albuminuria 1,1 g/24h. Nella stessa data il paziente ha deciso di iniziare il trattamento con Finerenone 10 mg.
Evoluzione del quadro Dopo un mese di trattamento è stato registrato un aumento di creatininemia (da 2,08 a 2,55 mg/dL), come atteso, e un aumento della potassiemia (da 4,5 a 5 mEq/L). Pertanto, non è stata necessaria nessuna modifica terapeutica ed il trattamento è proseguito per circa un anno con follow-up periodici in cui si effettuava la valutazione sia dei parametri clinici che laboratoristici. All’esame clinico di ogni visita non è stata registrata nessuna alterazione significativa rispetto a quanto riscontrato prima dell’introduzione del Finerenone: peso corporeo stabile nel tempo, frequenza cardiaca sempre nei range di normalità (60-100 bpm), pressione arteriosa sempre tra 110/70 mmHg e 130/80 mmHg, edemi declivi sempre assenti, parametri risultati stabili anche dopo la titolazione del farmaco a 20 mg, avvenuta a maggio 2025.
Per quanto riguarda i parametri laboratoristici: il Finerenone ha determinato una caduta progressiva di proteinuria e albuminuria con un GFR stabile nel tempo. L’andamento dei suddetti parametri non è stato lineare ma con delle variazioni caratteristiche. In particolare:
- sia all’introduzione del Finerenone 10 mg, sia alla titolazione a 20 mg sono corrisposti incrementi di creatininemia, riscontrabili però solo dopo il primo mese, mentre nei mesi successivi si è tornati ad avere un GFR uguale a quello antecedente l’introduzione del farmaco e soprattutto stabile nel tempo (Figura 1).
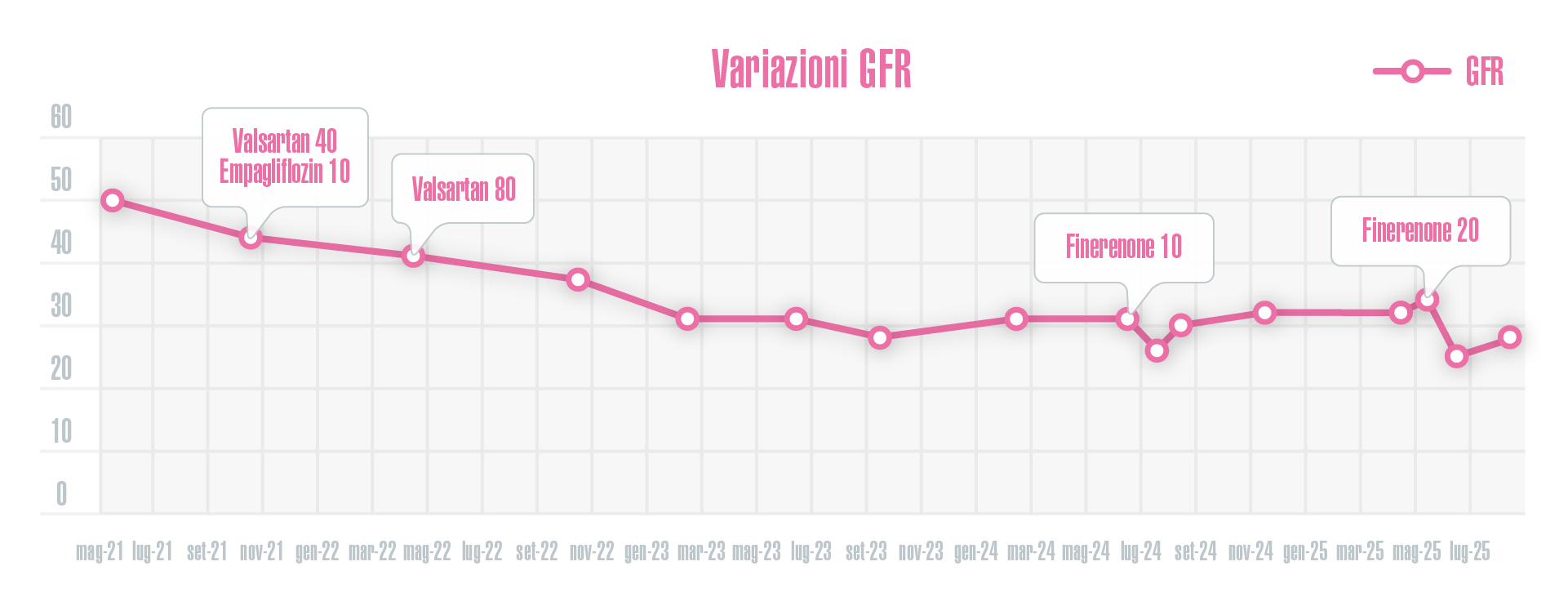 Figura 1 - Variazioni nel tempo di GFR espresso in mL/min/1,73 m2.
Figura 1 - Variazioni nel tempo di GFR espresso in mL/min/1,73 m2.
- sia all’introduzione del Finerenone 10 mg, sia alla titolazione a 20 mg sono corrisposti una notevole riduzione dei valori di albuminuria e proteinuria dopo il primo mese, seguiti da un lieve rialzo e una caduta più lenta e progressiva nei mesi successivi (Figura 2).
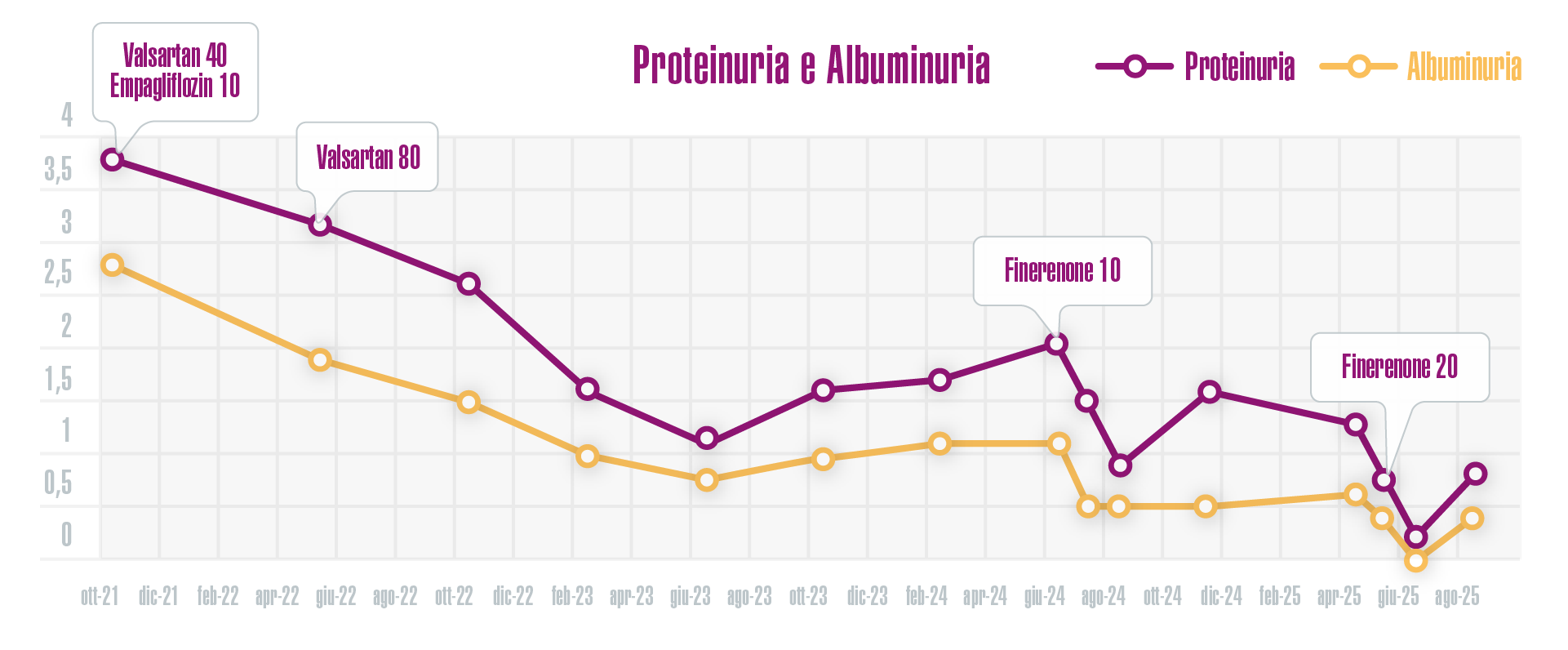 Figura 2 - Variazioni nel tempo di proteinuria (in viola) e di albuminuria (in giallo), espresse in g/24h.
Valutazione degli eventi avversi
Sono stati monitorati i livelli di potassiemia e non è stato mai riscontrato un livello K+ >5 mEq/L durante tutto il periodo di trattamento con Finerenone. Pertanto, il trattamento è avvenuto in maniera continuativa, il farmaco non è stato mai sospeso e non è stata necessaria l’aggiunta di chelanti del potassio (Figura 3).
Figura 2 - Variazioni nel tempo di proteinuria (in viola) e di albuminuria (in giallo), espresse in g/24h.
Valutazione degli eventi avversi
Sono stati monitorati i livelli di potassiemia e non è stato mai riscontrato un livello K+ >5 mEq/L durante tutto il periodo di trattamento con Finerenone. Pertanto, il trattamento è avvenuto in maniera continuativa, il farmaco non è stato mai sospeso e non è stata necessaria l’aggiunta di chelanti del potassio (Figura 3).
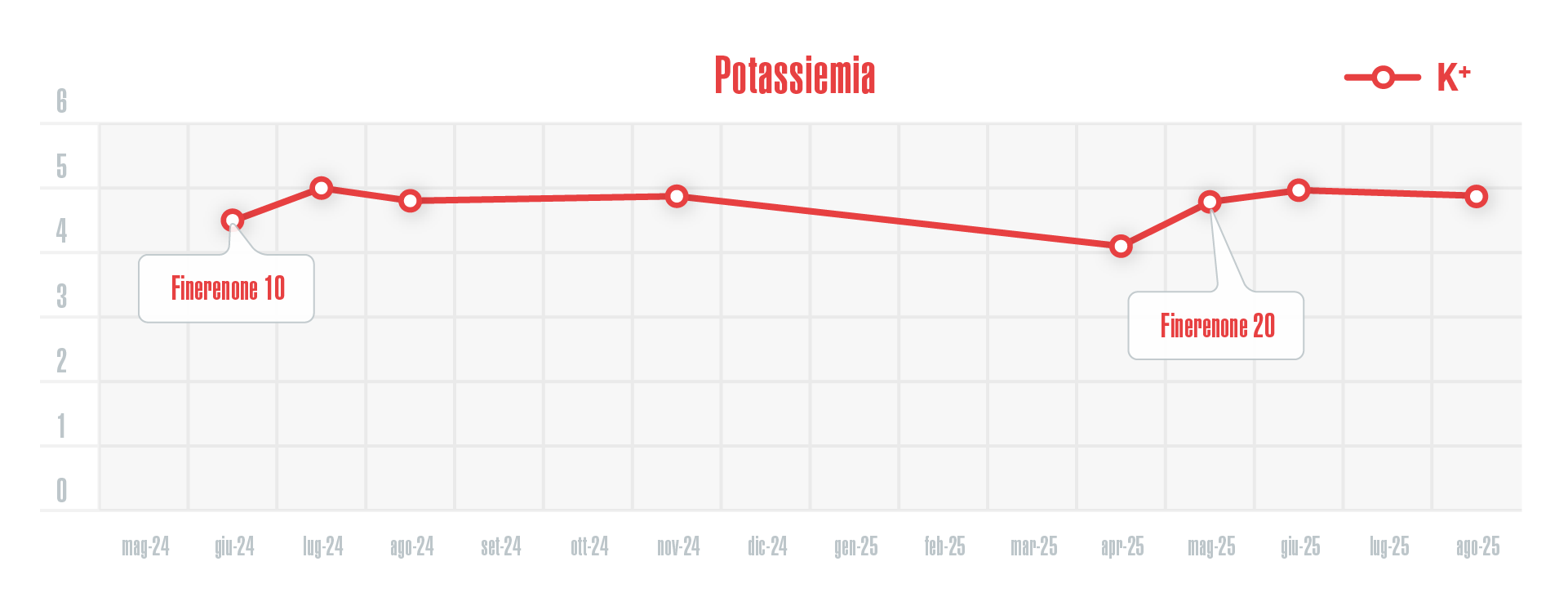 Figura 3 - Valori di potassiemia (espressi in mEq/L) durante il trattamento con Finerenone.
Figura 3 - Valori di potassiemia (espressi in mEq/L) durante il trattamento con Finerenone.
Interpretazione dei risultati
Sono stati registrati notevoli miglioramenti di proteinuria e di albuminuria e una riduzione della progressione della malattia renale valutata attraverso il calcolo del GFR decline. In particolare:
- Si è potuto far fronte ad un nuovo incremento di proteinuria e albuminuria insorti dopo tre anni di trattamento con RAS-inibitori alla massima dose tollerata ed SGLT2-inibitori. Grazie alla terapia con Finerenone, in un anno di trattamento, si è potuta determinare un’ulteriore riduzione della proteinuria che è risultata del 61% (da 2,04 a 0,8 g/24h) e dell’albuminuria del 73% (da 1,1 a 0,3 g/24h).
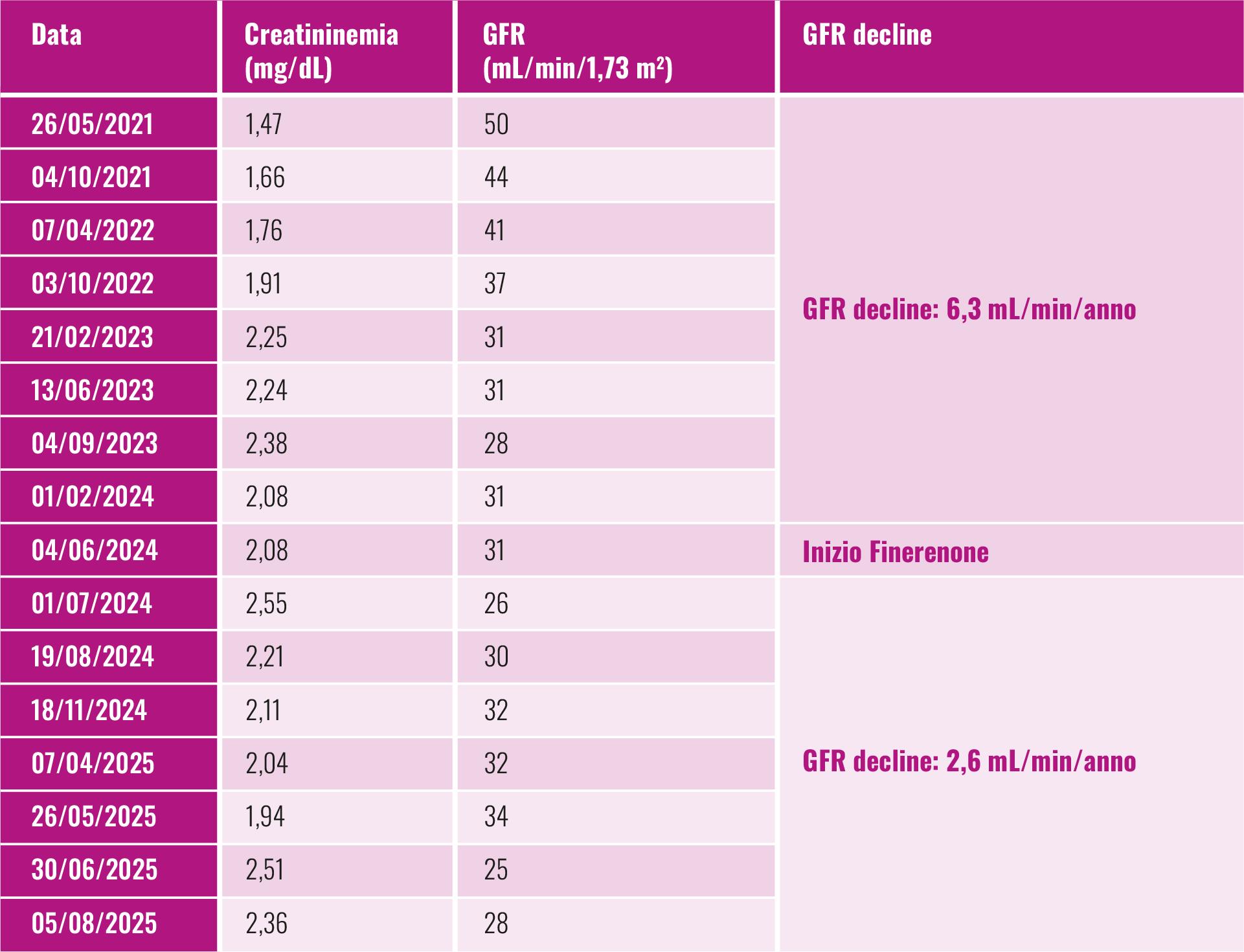
- Nella valutazione del GFR decline (Tabella 1):
a) prima del trattamento con Finererenone, attraverso la terapia con RAS-inibitori alla massima dose tollerata ed SGLT2-inibitori (passando da un GFR di 50 mL/min/1,73 m2 ad maggio 2021 a 31 mL/min/1,73 m2 a giugno 2024 ) il GFR decline era di 6,3 mL/min/anno.
b) aggiungendo il Finerenone in terapia, il GFR è passato da 31 mL/min/1,73 m2 a giugno 2024 a 28 mL/min/1,73 m2 ad agosto 2025, con un GFR decline di 2,6 mL/min/anno.
Quindi una riduzione della caduta del filtrato del 59%.
Tabella 1 - Valutazione del GFR decline prima e dopo l’introduzione del Finerenone.
È stata inoltre effettuata un’ulteriore analisi sull’aspettativa di vita lontano dalla dialisi. Si stima che:
- Prima dell’introduzione in terapia del Finerenone un paziente che aveva un filtrato di 31 mL/min/1,73 m2 a 74 anni, con un GFR decline di 6,3 mL/min/anno sarebbe arrivato alla necessità di iniziare la dialisi a circa 77 anni (tempo di vita lontano dalla dialisi di circa 3 anni);
- Con l’introduzione del Finerenone, avendo raggiunto in un anno di terapia un filtrato di 28 mL/min/1,73 m2 a 75 anni, con un GFR decline di 2,6 mL/min/anno arriverebbe alla necessità di iniziare la dialisi a circa 81 anni (tempo di vita lontano dalla dialisi di circa 6 anni).
Pertanto, in questo paziente il tempo di vita lontano dalla dialisi, grazie al trattamento con Finerenone, è raddoppiato.
Gradimento del paziente
Il Finerenone ha rappresentato una nuova opportunità di cura in un paziente che stava iniziando a peggiorare nonostante già facesse uso di farmaci cardioprotettivi e nefroprotettivi. La presa di coscienza di una condizione progressiva ha fatto sì che il paziente si affidasse alle cure mettendo da parte timori e perplessità. Nel tempo, nonostante i dubbi iniziali, il paziente si è fortemente ricreduto sull’efficacia del nuovo trattamento con Finerenone ed è rimasto felicemente sorpreso dai miglioramenti ottenuti. Ad oggi è totalmente compliante, attento alle terapie e felice di condurre una vita ancora lontano dalla dialisi.
Conclusioni
Nel management della malattia renale diabetica di questo paziente è stato utilizzato un approccio di tipo “stepwise” introducendo più di un farmaco nefroprotettivo (RAS-inibitori + SGLT2-inibitori + Finerenone). Con l’aggiunta del Finerenone, dopo un anno di trattamento, si è determinata una riduzione del 61% di proteinuria, del 73% di albuminuria e del 59% del GFR decline. Il trattamento con Finerenone rappresenta oggi una grande arma per migliorare gli outcomes renali di proteinuria e albuminuria nei pazienti con malattia renale diabetica. Risulta, inoltre, efficace nel ridurre la progressione dell’insufficienza renale cronica, riuscendo a stabilizzare la caduta del GFR, ampliando il tempo di vita lontano dalla dialisi e contribuendo a garantire una buona qualità di vita. È da considerare, quindi, uno dei pilastri della nefroprotezione, che, agendo attraverso un meccanismo d’azione differente, può essere utilizzato insieme agli altri farmaci nefroprotettivi per potenziarne i benefici, e determinando, quindi, un effetto aggiuntivo e sinergico.
L’esperienza riportata vuole essere, oltre che una testimonianza dei notevoli effetti del Finerenone come opportunità terapeutica della nefropatia diabetica, anche uno specchio della realtà clinica quotidiana, fatta anche di sfide per superare ostacoli di compliance per l’inizio di un trattamento che a volte possono risultare tanto banali quanto complessi. Alla base delle strategie di trattamento si rende necessaria la personalizzazione del rapporto medico-paziente, che, attraverso una fine ricerca empatica, si esplica anche nella scelta dell’approccio di comunicazione più efficace, che tenendo conto delle singole inclinazioni, sia in grado di condurre il paziente verso l’eliminazione degli atteggiamenti di chiusura, costruendo la fiducia verso le nuove frontiere di trattamento, che sono già state sperimentate e considerate come valide e sicure.
Contributo degli autori M. G. A. ha condotto le attività di selezione del caso clinico, analisi degli effetti del trattamento, scrittura del paper, realizzazione dei grafici. C. G. ha supervisionato lo studio.


Lascia un commento