Introduzione
La malattia renale cronica (chronic kidney disease, CKD) rappresenta una condizione clinica ad elevata prevalenza e impatto prognostico, associata a un significativo aumento del rischio di eventi cardiovascolari, insufficienza renale terminale e mortalità. Attualmente, la CKD è riconosciuta come una patologia sistemica complessa, caratterizzata da una progressione spesso silente e da un’elevata eterogeneità clinica, che contribuiscono a un ritardo diagnostico e terapeutico, soprattutto nelle fasi iniziali della malattia1,2.
Nel corso degli ultimi anni, il paradigma di gestione della CKD ha subito una profonda evoluzione. Accanto al controllo dei fattori di rischio tradizionali, quali ipertensione arteriosa e diabete mellito, è emersa con crescente evidenza l’importanza di strategie terapeutiche mirate alla protezione d’organo. Questo cambiamento ha favorito il passaggio da un approccio prevalentemente reattivo, focalizzato sulla gestione delle complicanze, a un modello più proattivo, orientato alla modifica della storia naturale della malattia e alla prevenzione della progressione del danno renale3.
Un ruolo centrale in tale contesto è rivestito dall’albuminuria, oggi considerata non solo un marker di danno glomerulare, ma anche un indicatore prognostico indipendente di progressione della CKD e di rischio cardiovascolare4. Numerose evidenze hanno dimostrato come la riduzione dell’albuminuria si associ a un miglioramento degli outcome renali e cardiovascolari, rendendola un obiettivo terapeutico rilevante nella gestione della CKD5. Di conseguenza, l’identificazione precoce dei pazienti con albuminuria persistente e la sua riduzione nel tempo assumono un valore cruciale per l’ottimizzazione del percorso terapeutico2,3.
Parallelamente, si è consolidato il concetto di intervento precoce nella CKD. Il danno renale, una volta instaurato e strutturalmente avanzato, risulta spesso solo parzialmente reversibile; pertanto, il timing di introduzione delle strategie nefroprotettive rappresenta un elemento determinante per massimizzare il beneficio clinico. L’avvio tempestivo di interventi mirati nelle fasi iniziali della presa in carico nefrologica può contribuire a rallentare la progressione della malattia, preservare la funzione renale residua e ridurre il rischio di eventi avversi a lungo termine.
In questo scenario si inserisce il concetto di CKD come continuum cardio-renale, in cui il danno renale e quello cardiovascolare si influenzano reciprocamente attraverso meccanismi patogenetici condivisi, tra cui disfunzione endoteliale, infiammazione cronica e attivazione neuro-ormonale. Tale visione integrata sottolinea la necessità di un approccio terapeutico globale, che tenga conto non solo della funzione renale, ma anche del profilo cardiovascolare complessivo del paziente.
L’introduzione di nuove classi farmacologiche con comprovate proprietà nefroprotettive ha ampliato in modo significativo le opzioni terapeutiche disponibili, offrendo la possibilità di intervenire su diversi meccanismi patogenetici della CKD6 Tuttavia, la traduzione delle evidenze derivanti dai trial clinici nella pratica quotidiana rimane complessa, soprattutto nei pazienti con quadri clinici articolati e pluricomorbidità. In questo contesto, il divario tra dati sperimentali e real-world rappresenta una sfida rilevante per il clinico, rendendo necessario un adattamento personalizzato delle strategie terapeutiche.
Alla luce di queste considerazioni, la presentazione di casi clinici real-world assume un ruolo particolarmente rilevante nel comprendere come l’applicazione precoce, progressiva e personalizzata delle strategie nefroprotettive possa tradursi in benefici clinici concreti. Il caso qui descritto si inserisce in questo contesto, offrendo uno spunto di riflessione sul valore di una presa in carico tempestiva e integrata nella gestione della CKD.
Presentazione del caso clinico
Il paziente è un uomo di 57 anni, proprietario di un bar, con indice di massa corporea pari a 32,5 kg/m² e in assenza di familiarità nota per nefropatie. Il quadro clinico risulta caratterizzato dalla presenza di molteplici fattori di rischio cardiovascolare e metabolico, tra cui ipertensione arteriosa di lunga data, diabete mellito di tipo 2, obesità di primo grado, dislipidemia e una storia di gotta, configurando complessivamente un profilo di rischio cardiovascolare globale elevato.
L’ipertensione arteriosa era nota fin dall’età di 32 anni ed era stata a lungo scarsamente controllata, nonostante l’impiego di più classi di farmaci antipertensivi nel corso degli anni. Il diabete mellito di tipo 2 era stato diagnosticato da diversi anni e presentava un controllo glicemico complessivamente adeguato (Hb glicata 6,3%), in assenza di segni clinici o strumentali di retinopatia diabetica. Negli anni precedenti il paziente aveva seguito un follow-up specialistico irregolare, con conseguente documentazione frammentaria dell’andamento clinico e laboratoristico, in particolare per quanto riguarda la funzione renale, rendendo non ricostruibile con precisione la sua evoluzione nel tempo né identificabile con certezza il momento di insorgenza del danno renale.
Nel mese di agosto 2024 venivano riscontrati valori di creatininemia pari a 2,45 mg/dL, corrispondenti a un filtrato glomerulare stimato (eGFR), calcolato mediante equazione CKD-EPI, di 28 mL/min/1,73 m², associati a proteinuria pari a 460 mg/die e a un rapporto albumina/creatinina urinaria (ACR) superiore a 300 mg/g, indicativi di un quadro di CKD avanzata con significativa componente albuminurica. Alla luce di tali riscontri laboratoristici, il paziente veniva inviato a valutazione nefrologica specialistica.
L’esame ecografico dell’addome, eseguito nel settembre 2024, mostrava reni in sede, di dimensioni e spessore parenchimale nei limiti di norma, con ecostruttura conservata e in assenza di segni di ostruzione delle vie urinarie. Si segnalava esclusivamente la presenza di alcune cisti subcentimetriche bilaterali, prive di significato patologico e non suggestive di una nefropatia cistica.
Considerata la complessità del quadro clinico, la discrepanza tra il grado di compromissione funzionale e l’assenza di alterazioni strutturali ecografiche significative, nonché la necessità di una definizione eziologica accurata del danno renale, veniva eseguita una biopsia renale a scopo diagnostico. L’esame istologico documentava un quadro di nefropatia cronica multifattoriale, con reperti compatibili con un interessamento su base diabetica e ipertensiva, associato a coinvolgimento tubulo-interstiziale, in assenza di elementi suggestivi per una patologia glomerulare primitiva attiva.
Al momento della prima valutazione nefrologica, il paziente assumeva una terapia antipertensiva comprendente olmesartan 20 mg/die, amlodipina 10 mg/die, nebivololo 5 mg/die e doxazosina 4 mg/die, associata a terapia ipolipemizzante con atorvastatina 40 mg/die, trattamento ipouricemizzante con febuxostat 80 mg/die e terapia antidiabetica con linagliptin 5 mg/die. Non venivano riferiti episodi recenti di scompenso glicemico né eventi cardiovascolari maggiori.
In considerazione della presenza di una CKD inserita in un contesto clinico complesso, caratterizzato da diabete mellito di tipo 2, ipertensione arteriosa e ulteriori fattori di rischio cardiovascolare, veniva effettuata una valutazione prognostica strutturata del rischio di progressione della malattia renale. In tale contesto, il rischio di evoluzione verso insufficienza renale terminale veniva stimato mediante la Kidney Failure Risk Equation nella sua versione a 8 variabili, che documentava una probabilità di circa il 30% a cinque anni7,8. Tale valutazione prognostica contribuiva a definire in modo più accurato il profilo di rischio del paziente e a orientare l’impostazione di una strategia gestionale mirata e integrata.
Alla luce di tali considerazioni, veniva avviato un percorso di presa in carico multidisciplinare, con il coinvolgimento del cardiologo, del diabetologo e del dietista, finalizzato all’ottimizzazione del controllo dei fattori di rischio cardiovascolare e metabolico, alla definizione di una strategia terapeutica nefroprotettiva appropriata e a un monitoraggio longitudinale dell’evoluzione clinica nel tempo.
Gestione terapeutica ed evoluzione clinica
Alla prima valutazione nefrologica, il paziente presentava una terapia farmacologica articolata, riassunta in Tabella 1, espressione della complessità del quadro clinico e della presenza di molteplici comorbidità cardiovascolari e metaboliche. In considerazione del profilo clinico e prognostico emerso, veniva impostato un percorso di ottimizzazione terapeutica basato su una presa in carico multidisciplinare, con l’obiettivo di migliorare la protezione renale e cardiovascolare, garantendo al contempo un adeguato profilo di sicurezza e tollerabilità. Tale approccio prevedeva una rivalutazione critica delle terapie in atto e una pianificazione sequenziale degli interventi, guidata dall’andamento clinico e laboratoristico nel tempo.
Tabella 1 - Terapia farmacologica al momento della prima valutazione nefrologica.
In una fase iniziale, nel contesto del coinvolgimento tubulo-interstiziale documentato all’esame istologico, veniva intrapreso un ciclo di terapia corticosteroidea, successivamente sospeso nel corso del follow-up in assenza di ulteriori elementi suggestivi di attività infiammatoria. Contestualmente, la terapia antipertensiva veniva rivalutata e modulata, con introduzione di nifedipina a rilascio modificato e successiva titolazione in base ai valori pressori e alla tollerabilità clinica, con l’obiettivo di ottimizzare il controllo pressorio.
Nel corso della presa in carico multidisciplinare, e in particolare a seguito della valutazione diabetologica, veniva introdotto un inibitore del co-trasportatore sodio-glucosio di tipo 2 (SGLT2-i), empagliflozin alla dose di 10 mg/die. Il trattamento risultava ben tollerato e si associava a un miglior controllo pressorio, senza effetti avversi clinicamente rilevanti nel breve termine. Tale intervento si inseriva in una strategia volta a ottenere un duplice beneficio, metabolico e nefroprotettivo.
A distanza di circa un mese dall’avvio della terapia con SGLT2-i, in considerazione del persistente profilo di rischio renale e cardiovascolare e sulla base della risposta clinica iniziale, veniva introdotto finerenone nell’ambito della gestione nefrologica. Il farmaco veniva avviato mantenendo una stretta sorveglianza dei parametri laboratoristici, in particolare della funzione renale e dei livelli sierici di potassio, e affiancando specifiche indicazioni dietetiche finalizzate alla prevenzione dell’iperkaliemia, nell’ottica di garantire la continuità terapeutica e la sicurezza del trattamento nel medio-lungo termine.
L’introduzione progressiva, sequenziale e coordinata delle diverse strategie terapeutiche si associava a una marcata e progressiva riduzione dell’albuminuria. In particolare, ACR mostrava un decremento significativo nel corso del follow-up, fino a raggiungere valori pari a 20 mg/g, configurando un miglioramento clinicamente rilevante del danno renale, come illustrato in Figura 1. Tale andamento risultava coerente con l’effetto nefroprotettivo atteso della strategia terapeutica adottata.
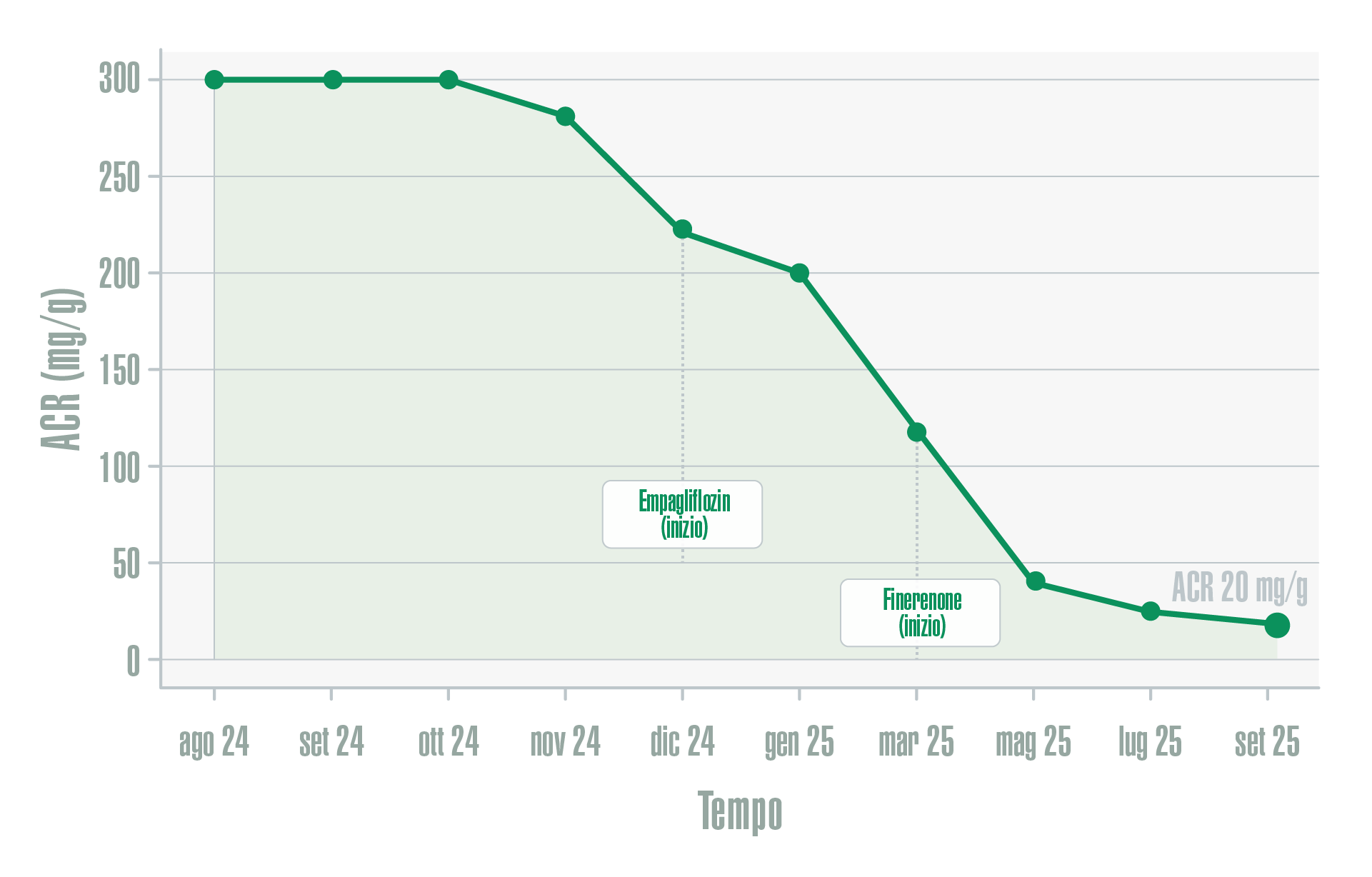 Figura 1 - Andamento del rapporto albumina/creatinina urinaria (ACR) nel corso del follow-up, con indicazione temporale dell’inizio della terapia con empagliflozin e finerenone.
Parallelamente, la funzione renale risultava complessivamente stabile nel tempo, senza evidenza di un deterioramento funzionale clinicamente significativo. L’andamento del eGFR documentava una sostanziale stabilità della funzione renale durante l’intero periodo di osservazione, come riportato in Figura 2, rafforzando l’interpretazione di un beneficio renale non ottenuto a scapito della funzione filtrante.
Figura 1 - Andamento del rapporto albumina/creatinina urinaria (ACR) nel corso del follow-up, con indicazione temporale dell’inizio della terapia con empagliflozin e finerenone.
Parallelamente, la funzione renale risultava complessivamente stabile nel tempo, senza evidenza di un deterioramento funzionale clinicamente significativo. L’andamento del eGFR documentava una sostanziale stabilità della funzione renale durante l’intero periodo di osservazione, come riportato in Figura 2, rafforzando l’interpretazione di un beneficio renale non ottenuto a scapito della funzione filtrante.
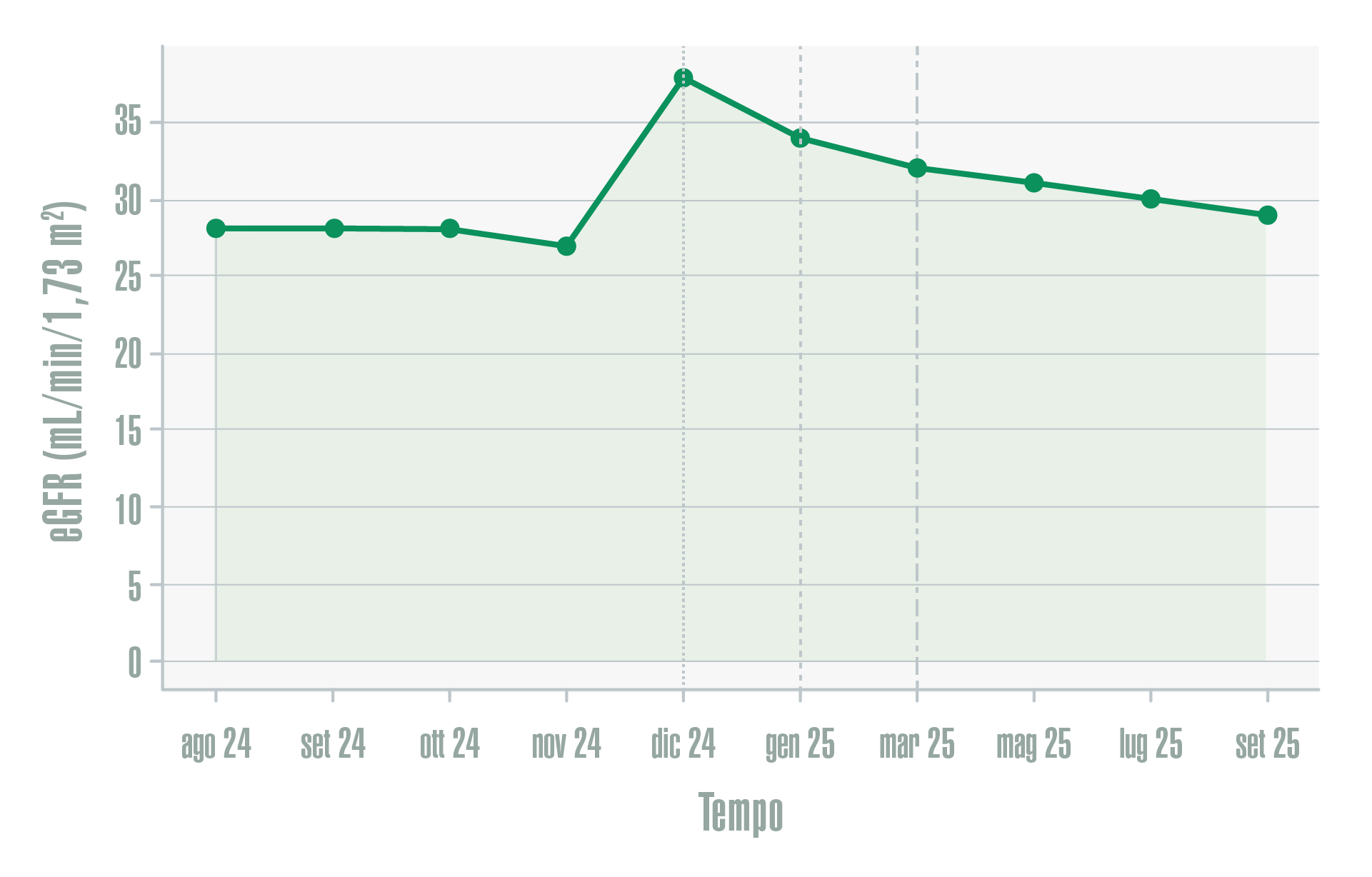 Figura 2 - Andamento del filtrato glomerulare stimato (eGFR) durante il follow-up
Per quanto riguarda il profilo di sicurezza, nel corso del follow-up si osservava un lieve incremento iniziale dei livelli sierici di potassio dopo l’introduzione di finerenone, successivamente stabilizzato mediante monitoraggio laboratoristico e ottimizzazione delle indicazioni dietetiche, senza necessità di sospensione o riduzione della terapia. L’andamento dei livelli di potassio nel tempo è riportato in Figura 3, confermando la possibilità di una gestione efficace e sostenibile dell’iperkaliemia in un contesto clinico controllato.
Figura 2 - Andamento del filtrato glomerulare stimato (eGFR) durante il follow-up
Per quanto riguarda il profilo di sicurezza, nel corso del follow-up si osservava un lieve incremento iniziale dei livelli sierici di potassio dopo l’introduzione di finerenone, successivamente stabilizzato mediante monitoraggio laboratoristico e ottimizzazione delle indicazioni dietetiche, senza necessità di sospensione o riduzione della terapia. L’andamento dei livelli di potassio nel tempo è riportato in Figura 3, confermando la possibilità di una gestione efficace e sostenibile dell’iperkaliemia in un contesto clinico controllato.
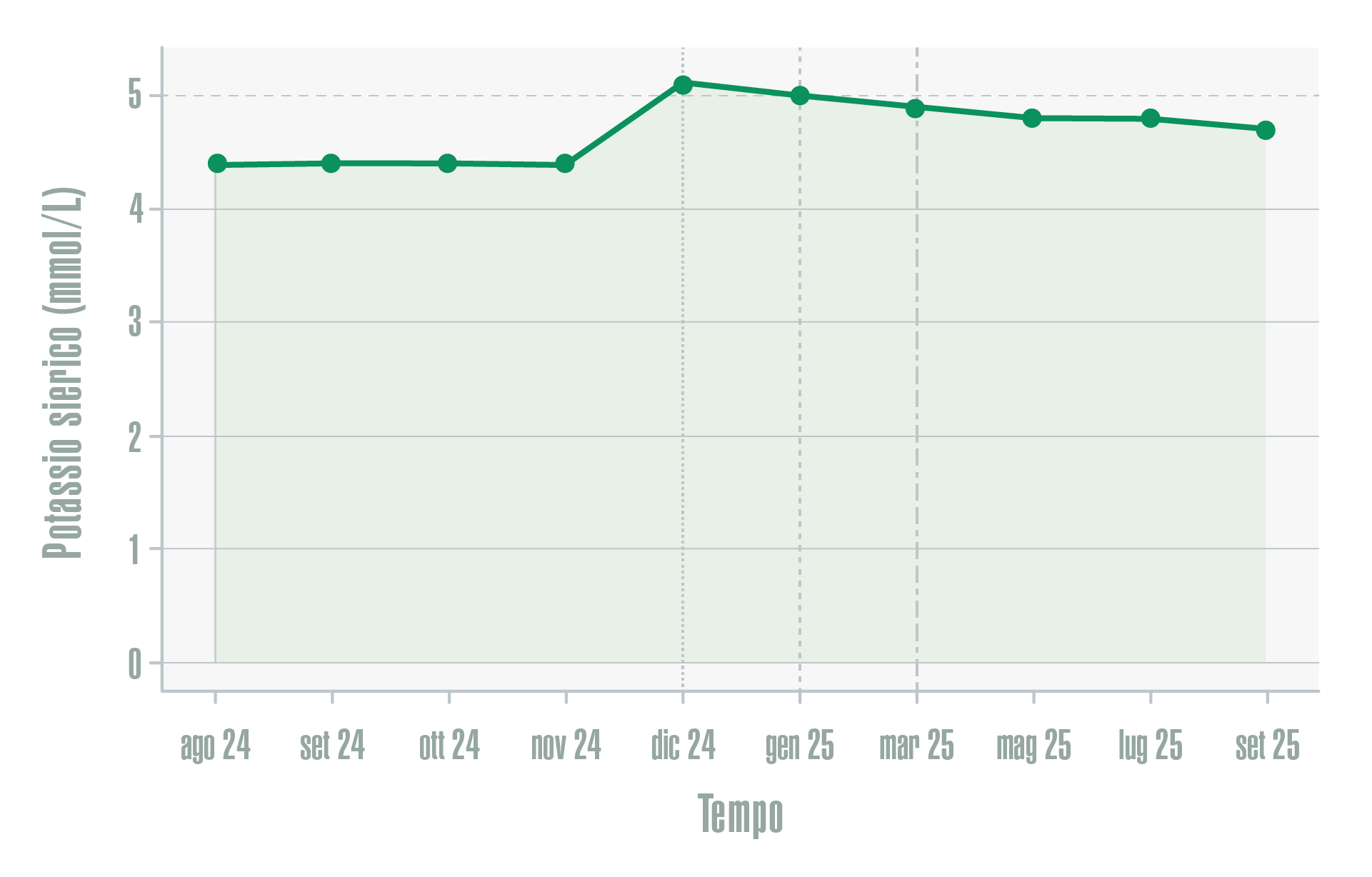 Figura 3- Andamento dei livelli sierici di potassio nel corso del follow-up in relazione alle modifiche terapeutiche
Il miglioramento dei parametri renali si accompagnava a un migliore controllo pressorio, che consentiva una progressiva semplificazione della terapia antipertensiva, nonché a un miglioramento del profilo metabolico complessivo e dell’aderenza terapeutica riferita dal paziente. L’evoluzione favorevole dei parametri clinici e laboratoristici si rifletteva infine in una rivalutazione prognostica. In particolare, la ricalcolazione del rischio mediante Kidney Failure Risk Equation nella versione a 8 variabili documentava una riduzione della probabilità di progressione verso insufficienza renale terminale fino a circa il 9% a cinque anni, rispetto alla stima iniziale, a conferma dell’impatto clinico della strategia terapeutica adottata.
Figura 3- Andamento dei livelli sierici di potassio nel corso del follow-up in relazione alle modifiche terapeutiche
Il miglioramento dei parametri renali si accompagnava a un migliore controllo pressorio, che consentiva una progressiva semplificazione della terapia antipertensiva, nonché a un miglioramento del profilo metabolico complessivo e dell’aderenza terapeutica riferita dal paziente. L’evoluzione favorevole dei parametri clinici e laboratoristici si rifletteva infine in una rivalutazione prognostica. In particolare, la ricalcolazione del rischio mediante Kidney Failure Risk Equation nella versione a 8 variabili documentava una riduzione della probabilità di progressione verso insufficienza renale terminale fino a circa il 9% a cinque anni, rispetto alla stima iniziale, a conferma dell’impatto clinico della strategia terapeutica adottata.
Discussione
Il caso clinico presentato documenta l’evoluzione favorevole di un paziente affetto CKD in un contesto di elevata complessità clinica, caratterizzato da comorbidità cardiovascolari e metaboliche e da un danno renale strutturale documentato istologicamente. L’elemento di maggiore interesse risiede nell’andamento longitudinale dei parametri renali nel corso del follow-up, che suggerisce come una gestione terapeutica integrata, personalizzata e avviata precocemente nel percorso di presa in carico nefrologica possa associarsi a un miglioramento clinicamente rilevante del danno renale, mantenendo al contempo un profilo di sicurezza favorevole.
In particolare, la riduzione progressiva dell’albuminuria osservata nel tempo rappresenta un outcome di rilievo clinico. Come illustrato in Figura 1, ACR si riduce fino a raggiungere valori pari a 20 mg/g, configurando un miglioramento sostanziale di un marker riconosciuto non solo come espressione di danno glomerulare, ma anche come fattore prognostico indipendente per la progressione della CKD e per il rischio cardiovascolare. La riduzione dell’albuminuria assume pertanto un significato clinico che va oltre la semplice variazione laboratoristica, suggerendo un potenziale rallentamento dei meccanismi patogenetici alla base della progressione del danno renale.
Un aspetto particolarmente rilevante è che il miglioramento dell’albuminuria si è verificato in assenza di un deterioramento della funzione renale. L’andamento del eGFR (Figura 2) documenta infatti una sostanziale stabilità della funzione renale nel corso dell’intero periodo di osservazione, rafforzando l’interpretazione di un beneficio renale complessivo, non ottenuto a scapito della funzione filtrante. Questo dato appare di particolare interesse in un paziente con danno renale strutturale documentato, nel quale la preservazione della funzione residua rappresenta un obiettivo clinico prioritario.
Dal punto di vista della sicurezza, l’introduzione di finerenone è stata seguita da un lieve incremento iniziale dei livelli sierici di potassio, successivamente stabilizzato mediante monitoraggio laboratoristico e indicazioni dietetiche mirate, senza necessità di sospensione del trattamento (Figura 3). Tale osservazione sottolinea come, anche in pazienti complessi, un’attenta sorveglianza clinica e laboratoristica consenta di mantenere terapie nefroprotettive efficaci, minimizzando il rischio di eventi avversi e favorendo la continuità terapeutica nel tempo9,10.
L’evoluzione clinica osservata si inserisce in modo coerente nel contesto delle evidenze generate dai principali trial randomizzati nel campo della nefroprotezione. Studi quali DAPA-CKD ed EMPA-KIDNEY11,12 hanno dimostrato che gli SGLT2-i sono in grado di ridurre significativamente il rischio di progressione della CKD e di eventi cardiovascolari maggiori, indipendentemente dalla presenza di diabete, consolidando il loro ruolo come pilastro della terapia nefroprotettiva.
Parallelamente, i trial FIDELIO-DKD e FIGARO-DKD13,14 hanno evidenziato come finerenone sia associato a una riduzione degli eventi renali e cardiovascolari nei pazienti con CKD e diabete di tipo 2, con un profilo di sicurezza favorevole se accompagnato da un adeguato monitoraggio del potassio sierico. L’analisi combinata FIDELITY ha ulteriormente rafforzato il razionale dell’impiego di finerenone all’interno di una strategia integrata di protezione renale e cardiovascolare15.
Un contributo particolarmente rilevante deriva dal trial CONFIDENCE, pubblicato sul New England Journal of Medicine, che ha dimostrato una riduzione significativamente maggiore dell’albuminuria con la combinazione di empagliflozin e finerenone rispetto alle singole monoterapie, fornendo un solido razionale fisiopatologico e clinico all’impiego sequenziale e integrato delle due classi farmacologiche. I risultati di tale studio supportano l’ipotesi che l’integrazione di meccanismi d’azione complementari possa tradursi in un beneficio additivo sul danno renale16.
Nel caso qui descritto, l’introduzione sequenziale e distanziata nel tempo delle terapie nefroprotettive, guidata dalla valutazione clinica e laboratoristica, appare coerente con tali evidenze e ne rappresenta una possibile traduzione nella pratica clinica reale. L’approccio graduale ha consentito di monitorare in modo puntuale efficacia e sicurezza dei singoli interventi, adattando la strategia terapeutica alle caratteristiche del paziente e favorendo una buona aderenza nel tempo.
Un ulteriore elemento di interesse è rappresentato dalla precocità della presa in carico nefrologica rispetto alla storia naturale della malattia. Sebbene il paziente presentasse già un danno renale strutturale documentato istologicamente, l’avvio tempestivo di una strategia terapeutica mirata ha consentito di intervenire in una fase in cui una quota di funzione renale risultava ancora preservata. Questo aspetto sottolinea l’importanza di un’identificazione precoce dei pazienti a rischio e di una collaborazione interdisciplinare efficace, al fine di massimizzare il potenziale beneficio delle strategie nefroprotettive disponibili.
Nel complesso, questo caso suggerisce che una gestione precoce, progressiva e personalizzata della CKD, basata sull’integrazione delle evidenze disponibili e su un attento monitoraggio clinico e laboratoristico, possa tradursi in benefici clinici concreti anche al di fuori dei contesti sperimentali controllati, contribuendo a colmare il divario tra dati dei trial randomizzati e pratica clinica quotidiana.
Nel contesto della pratica clinica quotidiana, la gestione della CKD si confronta frequentemente con pazienti caratterizzati da elevata complessità clinica, pluricomorbidità e percorsi assistenziali frammentati. In tale scenario, la trasposizione delle evidenze derivanti dai trial randomizzati richiede un adattamento critico e personalizzato, che tenga conto non solo dell’efficacia delle singole terapie, ma anche della loro sequenza di introduzione, della tollerabilità e della sostenibilità nel tempo. Il caso presentato offre un esempio concreto di come una strategia terapeutica strutturata, graduale e guidata dalla risposta clinica possa essere applicata con successo in un contesto real-world.
Un elemento centrale emerso da questa esperienza è il ruolo della valutazione longitudinale del rischio e della risposta al trattamento. L’integrazione di parametri funzionali, marker prognostici e indicatori di sicurezza consente di orientare in modo dinamico le decisioni terapeutiche, superando un approccio statico alla gestione della CKD. In questo senso, il monitoraggio continuo dell’albuminuria, della funzione renale e del profilo elettrolitico assume un valore non solo descrittivo, ma decisionale.
Infine, il caso sottolinea l’importanza di una presa in carico precoce e multidisciplinare del paziente con CKD, capace di favorire l’aderenza terapeutica e di massimizzare il potenziale beneficio delle strategie nefroprotettive disponibili17. Tale approccio appare particolarmente rilevante in una fase storica in cui l’evoluzione delle opzioni terapeutiche rende possibile un intervento più efficace sulla storia naturale della malattia, a condizione che venga applicato in modo tempestivo e personalizzato.
Conclusioni
Il caso clinico presentato evidenzia come, in un paziente con CKD inserita in un contesto clinico complesso e caratterizzato da molteplici comorbidità cardiovascolari e metaboliche, una gestione terapeutica integrata, personalizzata e avviata precocemente nel percorso di presa in carico nefrologica possa associarsi a un miglioramento clinicamente rilevante dei parametri renali. In particolare, l’introduzione sequenziale di strategie nefroprotettive si è accompagnata a una marcata riduzione dell’albuminuria, in assenza di un deterioramento della funzione renale e con il mantenimento di un profilo di sicurezza favorevole nel corso del follow-up.
L’esperienza descritta sottolinea il valore di un approccio proattivo e graduale alla nefroprotezione, basato su una valutazione dinamica del profilo di rischio e su un attento monitoraggio clinico e laboratoristico. In un’epoca in cui la disponibilità di nuove opzioni terapeutiche ha ampliato significativamente le possibilità di intervento nella CKD, la capacità di integrare tali strategie in modo razionale e sostenibile rappresenta un elemento chiave della pratica nefrologica quotidiana.
Un ulteriore aspetto di rilievo è rappresentato dal ruolo della precocità dell’intervento. Anche in presenza di un danno renale strutturale documentato, l’avvio tempestivo di una strategia terapeutica mirata ha consentito di ottenere un miglioramento dei marker prognostici e di stabilizzare la funzione renale residua, suggerendo come una presa in carico nefrologica anticipata possa incidere in modo significativo sull’evoluzione della malattia. Questo elemento appare particolarmente rilevante nella gestione di pazienti ad alto rischio, nei quali il ritardo nell’ottimizzazione terapeutica può tradursi in una perdita irreversibile di funzione renale.
Nel complesso, il caso presentato contribuisce a rafforzare il concetto che la gestione della CKD non debba essere intesa come un intervento statico, ma come un processo dinamico, che richiede una rivalutazione continua delle strategie terapeutiche in base alla risposta clinica e laboratoristica del singolo paziente. In tale prospettiva, un approccio multidisciplinare e personalizzato si configura come uno strumento fondamentale per tradurre le evidenze scientifiche disponibili in benefici clinici concreti nella pratica reale.


Lascia un commento