Introduzione
La perdita di coscienza transitoria (PdC) può essere definita come un’interruzione di breve durata dello stato di coscienza, spontanea e non legata ad un trauma cranico, con completa ripresa al termine.1 Circa il 50% della popolazione generale presenterà nel corso della vita un episodio di perdita di coscienza.2 Infatti, la PdC rappresenta una delle più frequenti emergenze neurologiche3, responsabile del 3% degli accessi in Pronto Soccorso e dell’1% dei ricoveri in ambito ospedaliero2. In oltre il 90% dei casi, la PdC è riconducibile ad una delle seguenti tre condizioni patologiche: sincope, crisi epilettica, crisi psicogena non-epilettica (pshycogenic non-epileptic seizure, ovvero PNES).4 La diagnosi differenziale tra queste 3 entità nosologiche acquisisce un ruolo fondamentale nell’outcome del paziente, in quanto determina la modalità di trattamento da attuare nell’immediato e incide, in caso di errore, sul rischio di mortalità/morbidità del paziente, che differisce a seconda di quale sia stata la causa della PdC.5 Quanto sia complesso il percorso diagnostico differenziale è sottolineato dall’ elevata percentuale di “misdiagnosi”, che ammonta al 20-30% circa nei pazienti adulti.5 Come sottolineato da Leach et al., la percentuale di misdiagnosi di epilessia si riduce in relazione al grado di preparazione del clinico (5.6% di diagnosi di epilessia errate effettuate da neurologi versus 19.3% di errore diagnostico da parte di medici non specialisti).6
Al di là del grado di preparazione del clinico, altri fattori che possono condurre ad una diagnosi errata sono elencati nella Tabella 1.2,5
 Tabella 1. Possibili cause di misdiagnosi in caso di PdC.
Tabella 1. Possibili cause di misdiagnosi in caso di PdC.
Per poter effettuare una diagnosi corretta è necessario un inquadramento nosologico e semeiologico delle possibili cause di PdC e, nello specifico, l’attenzione in questo articolo sarà focalizzata sulla diagnosi differenziale tra sincope e crisi epilettica.
Sincope
In accordo con la European Society of Cardiology (ESC), la sincope è una PdC dovuta ad una transitoria ipoperfusione cerebrale globale caratterizzata da esordio improvviso, breve durata e spontanea e completa ripresa.7 Al termine di una sincope, il paziente sperimenta una subitanea ripresa della coscienza, presentandosi sin da subito orientato e congruo. In alcuni casi, è riconoscibile una fase prodromica, definita appunto “pre-sincopale”, che può essere seguita o meno dalla PdC ed è caratterizzata da sintomi, quali sensazione di “testa vuota”, nausea, sudorazione, astenia e disturbi visivi.7
Secondo uno studio epidemiologico condotto in Utah, la prevalenza annuale delle sincopi si aggira intorno a 9.5 su 1.000 abitanti, sebbene la maggior parte delle persone che presentano un episodio sincopale non sembra rivolgersi all’attenzione di uno specialista.8 Sono identificabili due picchi di maggiore prevalenza delle sincopi nella popolazione, di cui il primo si colloca tra i 10 ed i 30 anni d’età ed il secondo oltre i 65 anni d’età.9 Nello studio Framingham l’incidenza delle sincopi subiva un netto incremento da 5.7 eventi su 1.000 persone all’anno in uomini con età compresa tra 60 e 69 anni a 11.1 eventi su 1.000 persone all’anno in uomini con età compresa tra 70 e 79 anni.10 Questo dato era da correlare a cause differenti, che potevano essere o la ricomparsa di sincopi vaso-vagali già sperimentate in giovane età o la sincope poteva essere la prima manifestazione di una patologia cardiologica sottostante.11
Anche se la sincope è la conseguenza di una ipoperfusione cerebrale globale transitoria, diversi sono i meccanismi fisiopatologici che possono condurre a tale condizione (Figura 1) e che hanno portato alla classificazione delle sincopi (Tabella 2).
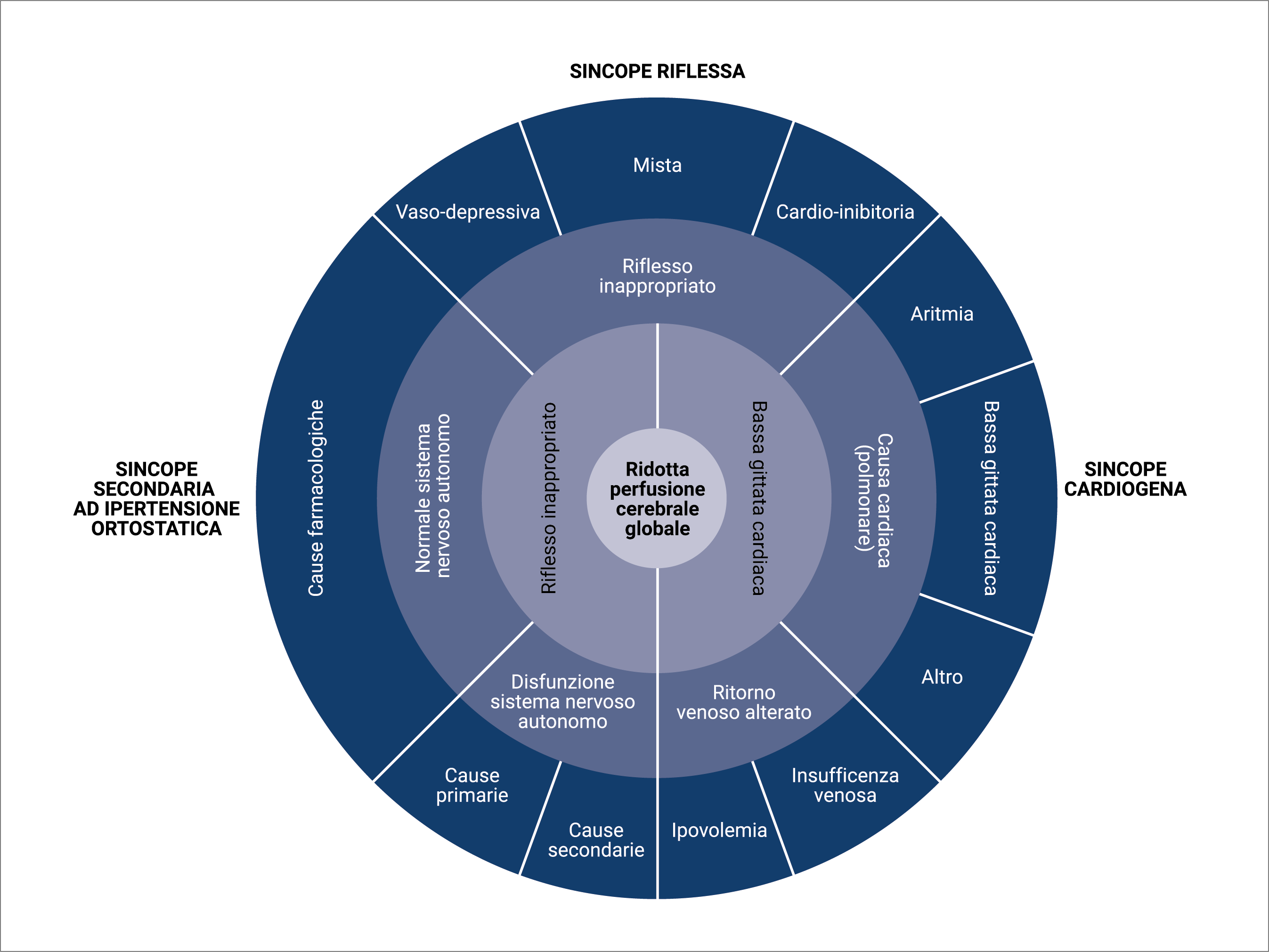 Figura 1. Basi fisiopatologiche della classificazione delle sincopi (tradotto e adattato da Guidelines for the diagnosis and management of syncope; Eur Heart J. 2009;30(21):2631–2671).
Figura 1. Basi fisiopatologiche della classificazione delle sincopi (tradotto e adattato da Guidelines for the diagnosis and management of syncope; Eur Heart J. 2009;30(21):2631–2671).
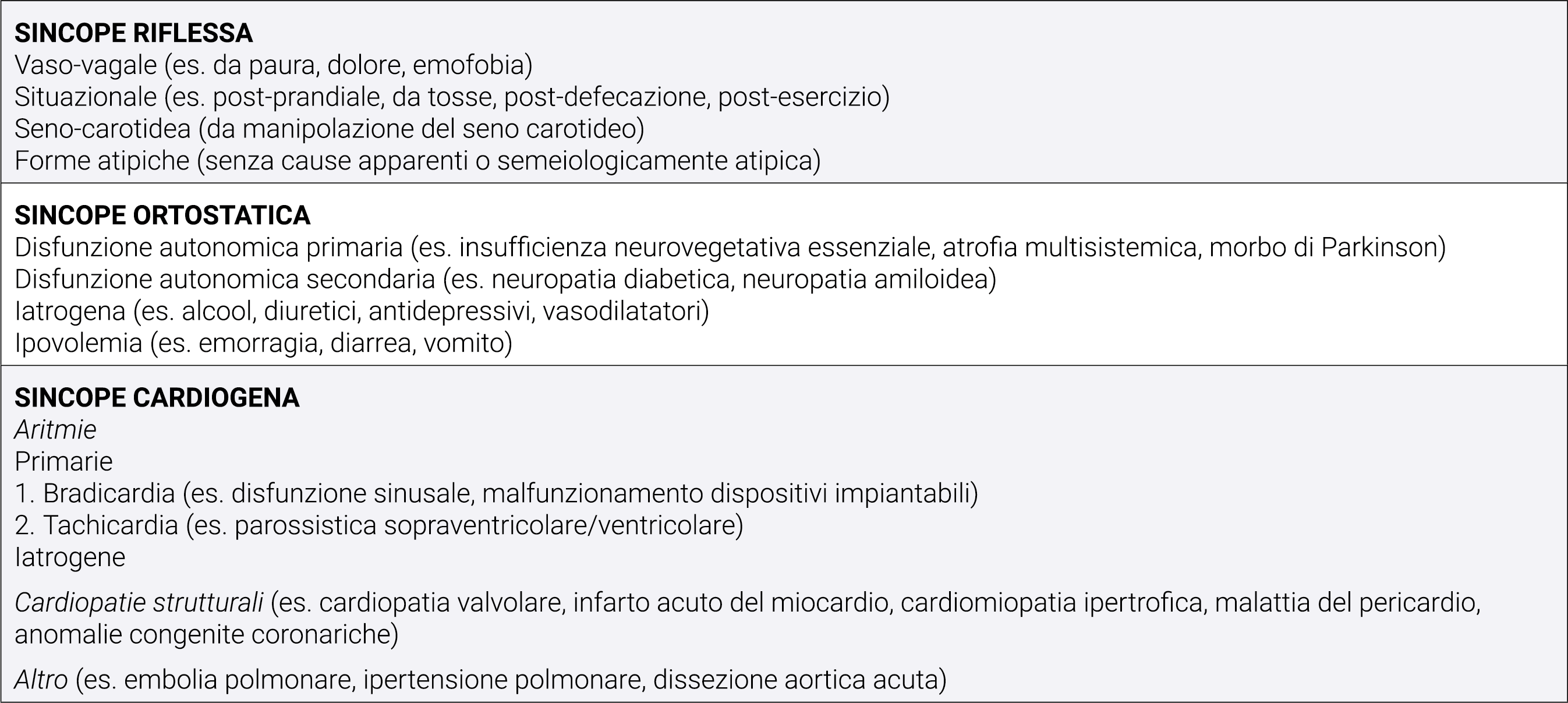 Tabella 2. Classificazione delle sincopi.7
Tabella 2. Classificazione delle sincopi.7
La prevalenza delle cause delle sincopi differisce a seconda dell’età e del setting in cui avviene la valutazione del paziente. In linea generale, le sincopi riflesse sono le più frequenti tra tutte, in tutte le età e setting. A seguire è la sincope cardiogena, prevalente in soggetti anziani e nell’ambito dell’urgenza. Anche l’ipotensione ortostatica sembra essere prevalente nei soggetti molto anziani. Nella Tabella 3, è riportata la frequenza delle cause di sincope in accordo con l’età del paziente.12
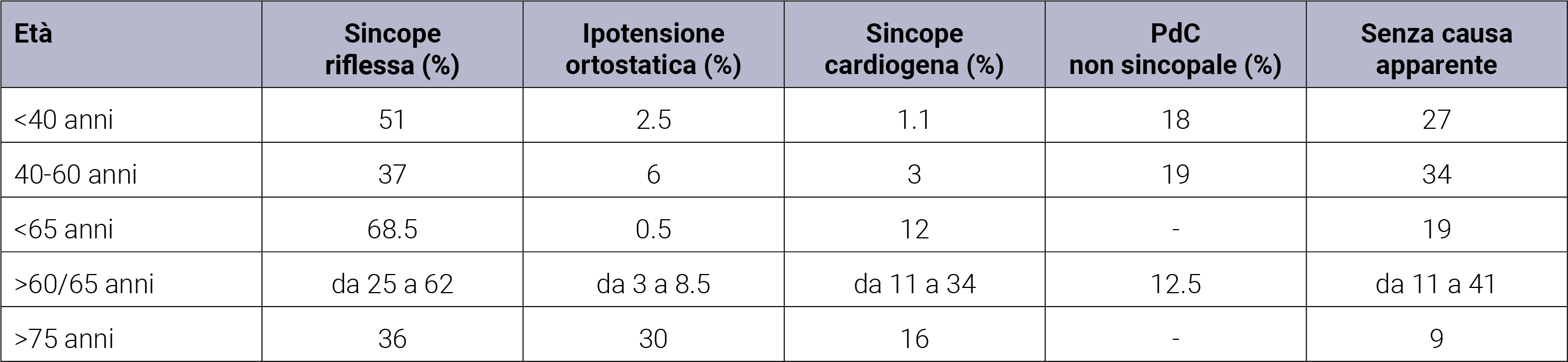 Tabella 3. Frequenza delle cause di sincope secondo l’età del paziente (tradotto e adattato da 2018 ESC Guidelines for the diagnosis and management of syncope - Supplementary Data; European Heart Journal (2018) 00, 1–12).
Tabella 3. Frequenza delle cause di sincope secondo l’età del paziente (tradotto e adattato da 2018 ESC Guidelines for the diagnosis and management of syncope - Supplementary Data; European Heart Journal (2018) 00, 1–12).
Per quanto riguarda la prognosi delle sincopi, due aspetti sono da considerare, ovvero:
- Il rischio di morte, che è certamente maggiore nei casi di sincope di origine cardiaca, soprattutto in presenza di cardiopatie strutturali o disturbi di conduzione cardiaci primari.7 Anche la sincope da ipotensione ortostatica si associa ad un rischio di morte due volte superiore rispetto alla popolazione generale, correlato soprattutto al grado di severità delle comorbidità associate.13
- Il rischio di ricorrenza delle sincopi e del danno fisico associato. Il numero di sincopi nel corso della vita è il fattore predittivo più forte di ricorrenza. Per esempio, pazienti con meno di 40 anni d’età, che abbiano sperimentato un episodio di sospetta natura sincopale nel corso della vita, hanno un rischio di ricorrenza del 10% a 1 anno e a 2 anni di distanza. Tale percentuale aumenta al 19% (ad 1 anno) e 29% (a 2 anni), se gli episodi sincopali sperimentati sono 2, mentre arriva al 40% (a 1 anno) e 54% (a 2 anni), se le sincopi sono ≥3.14 Le morbidità maggiori, ovvero fratture ed incidenti automobilistici, sono state riportate nel 6% dei pazienti, mentre morbidità di minore entità, come ferite o bruciature, sono state evidenziate nel 29% dei casi.7 La percentuale delle morbidità associate a sincopi è molto più elevata nei soggetti anziani, per i quali segue spesso l’ospedalizzazione.15
Crisi epilettica
La definizione di crisi epilettica è ormai consolidata ed è la seguente: "un’occorrenza transitoria di segni e/o sintomi dovuta ad un’attività neuronale cerebrale anomala, eccessiva o sincrona”.16 Il tipo di crisi viene definito in base alle modalità di esordio dell’anomala attività elettrica cerebrale-generalizzata, se la scarica interessa fin dall’inizio entrambi gli emisferi, o focale, se la scarica interessa inizialmente il network neuronale di un singolo emisfero, potendosi, successivamente, più o meno estendersi. Da un punto di vista semeiologico, le due principali caratteristiche descrittive sono la compromissione o meno della consapevolezza/coscienza e la presenza/assenza di manifestazioni motorie (Figura 2).16
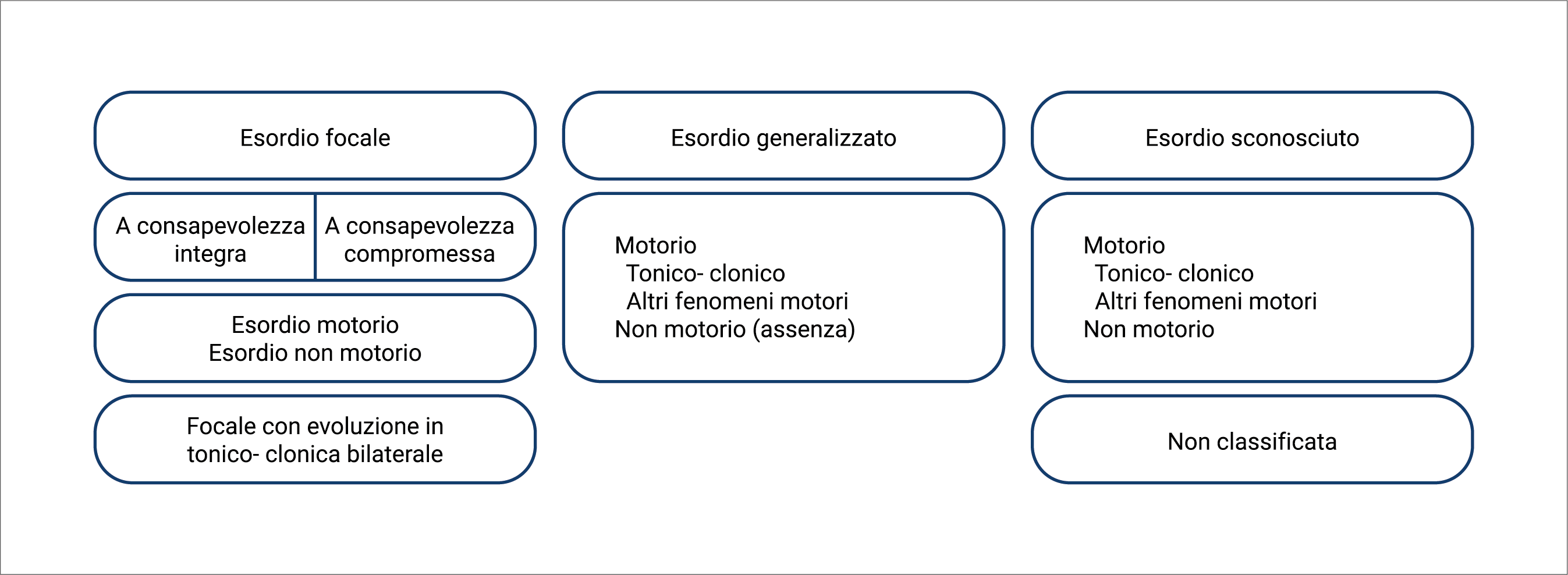 Figura 2. Classificazione dei tipi di crisi (tratto da Classificazione operativa dei tipi di crisi della International League Against Epilepsy: position paper della Commissione per la Classificazione e la Terminologia dell’ILAE; Epilepsia, 58(4):522–530, 2017).
Figura 2. Classificazione dei tipi di crisi (tratto da Classificazione operativa dei tipi di crisi della International League Against Epilepsy: position paper della Commissione per la Classificazione e la Terminologia dell’ILAE; Epilepsia, 58(4):522–530, 2017).
Si parla di epilessia in presenza di almeno due crisi epilettiche non provocate a distanza di 24 ore tra loro, oppure in presenza di una singola crisi non provocata in concomitanza a un rischio (definito sulla base delle caratteristiche elettroencefalografiche e/o di neuroimaging) >60% di presentare un secondo episodio critico nei 10 anni successivi, oppure in presenza di una sindrome epilettica già identificabile.17 L’epilessia è una patologia neurologica molto frequente che interessa lo 0.6-1% della popolazione mondiale18 ed ha un’incidenza di circa 50 su 100.000 persone all’anno con una distribuzione bimodale: un picco nei pazienti con <1 anno di vita ed un altro nei soggetti con >50 anni.19 Le cause dell’epilessia sono diverse a seconda dell’età considerata, con le malformazioni dello sviluppo cerebrale prevalenti nella giovane età ed i disturbi cerebrovascolari negli anziani.19 In seguito all’assunzione di farmaci anticrisi, circa 2/3 dei pazienti sarà libero da crisi, mentre il restante 30% circa rimarrà farmacoresistente.19 Considerato l’impatto sociale ed il carico lavorativo e farmacologico che la diagnosi di epilessia porta con sé, è intuitivo capire l’importanza di un corretto inquadramento di un episodio di PdC come crisi epilettica o meno. Si stima che circa il 10% delle persone presenterà una crisi epilettica nel corso della propria esistenza.20 Ed interpretare la prima crisi epilettica come sintomatica acuta (ovvero “vicina” temporalmente ad un evento acuto cerebrale) o non provocata risulta fondamentale, perché nel primo caso sarà sufficiente il trattamento della causa sottostante, mentre nel secondo potrebbe essere utile avviare una terapia anticrisi cronica.21 Senza dimenticare che cambia anche il rischio di ricorrenza di una seconda crisi epilettica non provocata che sarà, nei 10 anni successivi, intorno al 19%, in caso di prima crisi sintomatica acuta (non tenendo conto delle diverse eziologie sottostanti), e del 65%, in caso di crisi non provocata.22 Sebbene il rischio di avere una seconda crisi non provocata sia nettamente inferiore, in seguito ad una prima crisi sintomatica acuta, persone che sperimentino una prima crisi sintomatica acuta hanno un maggior tasso di mortalità nei 30 giorni immediatamente successivi all’episodio critico stesso.22
Diagnosi differenziale
La raccolta anamnestica (per mezzo di un testimone e attraverso il racconto del paziente) è un potente mezzo diagnostico – e può, talora, rivelarsi l’unico – per porre diagnosi di certezza di sincope o crisi epilettica.23 Tanto più è scrupolosa l’anamnesi e tanto più è esperto il clinico, maggiore sarà l’accuratezza diagnostica. Spesso il racconto del testimone, anziché essere d’aiuto, può risultare fuorviante, soprattutto se, come frequentemente accade, non è un “addetto ai lavori”, che giustamente sarà stato colto da paura e ansia assistendo all’evento, di cui, quindi, potrebbe non essere in grado di descrivere dettagli importanti.24 In casi del genere, un suggerimento molto rudimentale, ma pratico, potrebbe essere quello di chiedere al testimone di “mimare” ciò che ha visto. La raccolta anamnestica dovrebbe focalizzarsi su eventuali fattori precipitanti, sintomi e/o segni premonitori, la semeiologia dell’episodio di PdC ed i sintomi e/o segni presentati al termine dell’episodio stesso.25 Bisognerebbe, inoltre, indagare su eventuali pregressi episodi e raccogliere l’anamnesi familiare (familiarità per epilessia, morte improvvisa, aritmie cardiache) e personale del paziente, con particolare attenzione alla terapia domiciliare assunta, l’uso di sostanze voluttuarie ed il contesto socioculturale di appartenenza.25 Nella Tabella 4, sono riassunte alcune caratteristiche cliniche, che possono aiutare nella diagnosi differenziale.25,26
 Tabella 4. Tratti clinici distintivi tra sincope e crisi epilettica.
Tabella 4. Tratti clinici distintivi tra sincope e crisi epilettica.
La presenza di movimenti involontari durante un episodio di PdC potrebbe rendere difficile la diagnosi differenziale tra crisi tonico-clonica generalizzata e sincope complicata, ovvero accompagnata da violente contrazioni muscolari. Quello che aiuta è la durata ed il numero delle contrazioni (entrambi inferiori in caso di sincope) e la ritmicità ed il sincronismo dei movimenti involontari (entrambi assenti nelle sincopi).9 In uno studio del 2018, Shmuley et al hanno analizzato le caratteristiche semeiologiche dei fenomeni motori presentati da 65 pazienti con diagnosi di sincope e sottoposti al tilt-up test e di 50 soggetti con crisi convulsive generalizzate, registrate con il monitoraggio video-EEG. Quanto emerso è la cosiddetta “regola del 10/20”, ovvero un evento con meno di 10 fenomeni motori sembrerebbe indicare una sincope, piuttosto che una crisi tonico-clonica generalizzata, che ne presenterebbe più di 20. Inoltre, la perdita di tono muscolare sembrerebbe deporre più per un episodio sincopale che epilettico.27 La assenza/presenza di confusione post-critica è il principale marker diagnostico differenziale.
La valutazione dei parametri vitali, quali la pressione arteriosa e la frequenza cardiaca, può essere d’aiuto, soprattutto in caso di sincope da ipotensione ortostatica, così come l’auscultazione toracica può aiutare nell’identificazione di eventuali aritmie cardiache.25 L’esecuzione di un ECG e di un ecocardiogramma transtoracico può aiutare nell’identificazione di eventuali anomalie elettriche e strutturali a carico del sistema cardiaco.25
Le indagini neurologiche (EEG e RM encefalo) dovrebbero essere richieste solo se, a seguito dell’indagine anamnestica, si è posta una consistente ipotesi diagnostica di crisi epilettica.
Diversamente, tali esami potrebbero essere solo confondenti.
Tra gli esami strumentali, l’EEG, infatti, riveste un basso ruolo diagnostico nei pazienti con sincope, considerando che lo 0.5-2% dei giovani adulti sani presenta anomalie elettroencefalografiche interictali.25 Uno studio del 2014 ha dimostrato come l’EEG di 69 pazienti con risposta positiva al tilt-up test presentava dei pattern caratteristici durante l’ipoperfusione cerebrale che accompagna la sincope. Il tracciato può presentare un appiattimento durante la sincope provocata con il tilt-up test (pattern “slow-flat-slow”) ed associarsi ad una più severa ipoperfusione cerebrale, rispetto a quella che si accompagna ad un tracciato EEG più lento, ma senza appiattimento (pattern “slow”).28
Tali anomalie potrebbero essere interpretate da un clinico meno esperto in questo ambito come suggestive di crisi epilettica e spingere, pertanto, ad un errore diagnostico. Dopo aver posto diagnosi di crisi epilettica, è mandatorio sottoporre il paziente a TC del cranio o RM dell’encefalo per verificare la presenza di un’eventuale eziologia strutturale della crisi epilettica.25
Se consideriamo i biomarker laboratoristici nel contesto dell’urgenza, diversi studi sono stati condotti alla ricerca di marcatori ematici specifici per sincope o crisi epilettica. Il livello sierico dei lattati, a poche ore da un episodio di PdC, è tra i più studiati.29,30 In un recente studio, mettendo a confronto i livelli sierici dei lattati ottenuti a 2 h di distanza dall’evento di PdC di 195 pazienti con crisi tonico-cloniche generalizzate versus 106 pazienti con altri tipi di episodi (di cui 52 sincopi [6 complicate]), questi risultavano significativamente più elevati nel primo gruppo.31 Dei 6 pazienti con sincopi complicate, 2 presentavano elevati livelli di lattati sierici, ma gli autori concludevano che il numero dei pazienti era troppo limitato per poter trarre conclusioni definitive. Anche la creatin-chinasi rappresenta un marker di crisi tonico-clonica generalizzata ma, a differenza dei lattati, il suo incremento può verificarsi da alcune ore sino a giorni dopo l’evento, perdendo, dunque, la validità di marcatore precoce di crisi epilettica.31 Un nuovo biomarker che si sta analizzando negli ultimi tempi è la fosfatemia, che risulterebbe ridotta nelle crisi convulsive generalizzate, rispetto agli altri episodi di PdC;32 si tratta, tuttavia, di studi preliminari, che necessitano di ulteriore approfondimento.
Conclusioni
Gli episodi di PdC rappresentano delle sfide diagnostiche per il clinico, soprattutto quando questo non è diretto testimone dell’evento, e deve servirsi essenzialmente del “racconto” del testimone/paziente per raggiungere una conclusione diagnostica. Categorizzare l’evento è fondamentale per mettere in atto le più opportune scelte diagnostico-terapeutiche, cercando di evitare la recidiva dell’episodio. Tuttavia, a fronte di un primo episodio, rispetto al quale non si riescono a raccogliere i sufficienti dati per porre una diagnosi di certezza, sarebbe opportuno, dopo aver escluso condizioni mediche acute, non intraprendere un trattamento farmacologico anticrisi, condividendo con il paziente e ai suoi familiari tutti i pro e contro delle diverse strategie operative.


Lascia un commento