1. Epidemiologia del tromboembolismo venoso in oncologia
Già nel 1865, Armand Trousseau ipotizzò l’esistenza di una relazione tra cancro gastrico ed episodi tromboflebitici, osservandone una maggior frequenza in questa specifica popolazione oncologica. Da allora molti studi si sono susseguiti, confermando la frequente associazione tra il tromboembolismo venoso (TEV) e la patologia neoplastica. Si stima che circa il 5% dei soggetti con diagnosi di neoplasia sviluppino TEV, con un rischio medio circa 12 volte maggiore rispetto alla popolazione generale, ma che può arrivare ad essere anche 23 volte superiore in presenza di trattamento chemioterapico.1,2 Il TEV rappresenta, per i pazienti oncologici, una importante causa di deterioramento delle condizioni cliniche e di potenziale ritardo o interruzione del percorso terapeutico, oltre che di aumento della mortalità.3 In letteratura viene riportato un tasso di mortalità legato allo sviluppo di embolia polmonare (EP), correttamente trattata, compreso tra il 2% e 8%, con valori significativamente più elevati nella popolazione in analisi (Hazard Ratio [HR] 2.3; 95% Intervallo di confidenza [IC] 1.5–3.5).4 Il rischio relativo di sviluppare un episodio di TEV non è uguale per tutti i pazienti, ma dipende principalmente dal tipo di neoplasia, dal suo stadio e dal tipo di terapia oncologica attiva. Altri fattori secondari, spesso molto diffusi in questa popolazione, sono il numero dei ricoveri ospedalieri, la presenza e la tipologia di interventi chirurgici e l’ipomobilità derivante dallo scadere delle condizioni del paziente e dalla perdita di autonomia.
È importante sottolineare come la presenza di neoplasia attiva sia non solo associata ad un aumento del rischio trombotico, ma anche ad un concomitante incremento del rischio emorragico, con un’incidenza di sanguinamento maggiore stimata intorno a 3-5 volte superiore rispetto alla popolazione generale.5
La presente trattazione verterà sull’eziopatogenesi del TEV nel paziente oncologico, sulle strategie di prevenzione primaria e soprattutto sul trattamento nella fase acuta e in prevenzione secondaria, con un particolare focus su tinzaparina, la molecola eparinica a basso peso molecolare che possiede una indicazione specifica per questa categoria di pazienti.
2. I fattori di rischio TEV più frequentemente riscontrabili nei pazienti oncologici
Tipologia e stadio della neoplasia
I diversi meccanismi fisiopatologici e l’iter diagnostico e terapeutico delle diverse neoplasie comportano sostanziali differenze nel rischio di sviluppo di complicanze tromboemboliche. Nella recente letteratura viene riportato come l’incidenza del TEV possa variare da circa l’1% in caso di tumori della prostata e della mammella fino a valori prossimi al 20% nei pazienti con tumore del pancreas, che è stato da molto tempo associato ad un altissimo rischio di sviluppo di trombosi venosa profonda (TVP) ed EP.6 L’incidenza della patologia tromboembolica è stata estensivamente analizzata da un vasto studio di coorte, che ha incluso oltre 6500 pazienti con diagnosi di cancro e sviluppo di un primo episodio di TEV. I risultati hanno confermato l’esistenza di tumori a basso rischio di sviluppo di questa complicanza (2.7 – 7.0 casi per 100 persone-anno nei tumori della vescica, della mammella, della prostata, del colon, dell’utero e per le neoplasie ematologiche) e tumori ad alto rischio (10.1 – 14.6 casi per 100 persone-anno per neoplasie di polmone, stomaco, ovaio, pancreas ed encefalo).7
Inoltre, a parità di localizzazione primaria, tumori istologicamente differenti presentano una diversa incidenza di EP, come nel caso delle neoplasie polmonari8, dove l’adenocarcinoma polmonare mostra un rischio superiore rispetto al carcinoma squamoso, e delle neoplasie ovariche, dove gli adenocarcinomi producenti mucine presentano il rischio maggiore di sviluppo di EP e TVP.9,10 Tali differenze tra tipi istologici diversi non si verificano invece per le neoplasie della mammella e del colon.
Un’ulteriore differenza nel rischio di sviluppo di TEV scaturisce dal diverso grado delle neoplasie. I risultati del Vienna Cancer and Thrombosis Study (CATS) riportano come i pazienti affetti da neoplasie ad alto grado (G3 e G4) presentino un rischio doppio di sviluppo di TEV (HR 2.0; 95% CI, 1.1–3.5) rispetto ai pazienti affetti da neoplasie a basso grado. Infine, lo studio evidenzia come la predisposizione a sviluppare TEV aumenti al crescere dello stadio della neoplasia. In particolare, neoplasie localmente avanzate o metastatiche mostrano un rischio significativamente più alto di TEV rispetto alla malattia localizzata (rispettivamente, HR 3.7; 95% CI 1.1–9.6 e HR 5.4; 95% CI 2.3-12.9).11
Terapia oncologica
La terapia oncologica comprende numerosi strumenti terapeutici: la chirurgia, la chemioterapia, l’immunoterapia, la terapia ormonale e la radioterapia. Tutte queste modalità di trattamento sono associate, con vari meccanismi (vedi oltre), ad un aumentato rischio di sviluppo di TEV.
Se è già ben noto il rischio di TEV associato ad interventi di chirurgia maggiore, occorre ricordare che per la chirurgia oncologica questo rischio permane elevato per i 30 giorni successivi all’intervento, con tassi di incidenza intorno al 2%.12 Il rischio di TEV post-operatorio è stato riportato con frequenze maggiori per i tumori dei tessuti molli (10.6%) e polmonari (8.1%).13
Anche la chemioterapia è correlata ad un aumentato rischio di eventi tromboembolici. Uno studio nord-americano ha mostrato nei pazienti non in chemioterapia un rischio di TEV 4.1 volte superiore rispetto alla popolazione generale, mentre in presenza di chemioterapia questo rischio aumentava ulteriormente a 6.5 volte.1 Tra la chemioterapia tradizionale, quella a base di derivati del platino è risultata associata al maggior rischio trombotico. Il rischio relativo di sviluppare eventi tromboembolici in corso di terapia con questi agenti è stato di 1.67 volte superiore rispetto a farmaci chemioterapici differenti.14
Merita, inoltre, una menzione particolare l’utilizzo di talidomide. Infatti, sebbene il rischio associato alla monoterapia con talidomide sia relativamente basso (1.3 per 100 pazienti-ciclo), la co-somministrazione con desametasone causa un sostanziale aumento del rischio trombotico (4.1 per 100 pazienti-ciclo).15
Anche l’ormonoterapia è associata ad un aumentato rischio di eventi. Pazienti con cancro mammario trattate con tamoxifene hanno riportato tassi di TEV maggiori rispetto alle pazienti che non hanno ricevuto la terapia ormonale (1.2% e 0.5% a 5 anni rispettivamente), con un ulteriore incremento quando quest’ultima è associata a chemioterapia convenzionale (1.4% nel gruppo trattato con solo tamoxifene e 10.8% nel gruppo con concomitante chemioterapia).16,17 Anche alcuni tra i farmaci più recentemente resisi disponibili, come gli agenti inibenti chinasi ciclina-dipendenti e agenti antiangiogenetici, sono stati sospettati di favorire l’insorgenza di TEV. Due meta-analisi hanno dimostrato come l’utilizzo di farmaci inibenti l’epidermal growth factor receptor (EGFR) – es. cetuximab e panitumumab - sia associato ad un aumentato del rischio di TEV (rischio relativo (RR) rispet- tivamente 1.32 e 1.46).18,19 Agenti anti-angiogenici, come gli inibitori delvascular-endothelial growth factor (VEGF), sono stati associati da recenti metanalisi al rischio di eventi arteriosi, senza un effettivo incremento del tasso di tromboe bolismo venoso.20
Condizioni cliniche del paziente
I pazienti neoplastici sono spesso affetti anche da una serie di comorbilità che aggravano il quadro generale fino a ridurre la possibilità di mobilizzazione autonoma con progressiva perdita di autonomia nelle attività della vita quotidiana (AVQ). In particolare, come fattore di rischio tromboembolico, risulta importante la valutazione del performance status, misurabile ad esempio attraverso la scala formulata dal Eastern Cooperative Oncology Group (ECOG). In un recente studio è stato riportato come i pazienti con punteggio ECOG maggiore o uguale a 1 all’inizio di una terapia con inibitori del checkpoint siano esposti ad un maggior rischio di eventi di TEV (HR 3.02; 95% IC 1.01-9.04).21
Uno studio nord-americano di grande dimensione campionaria ha riportato come anche le comorbidità del paziente siano associate ad un aumentato rischio di sviluppo di TEV, in particolare la patologia arteriosa, la patologia polmonare, l’insufficienza renale, le infezioni e l’anemia (associazione mantenuta anche all’analisi multivariabile).22
3. Fisiopatologia dello sviluppo di TEV nel paziente oncologico
Il meccanismo fisiopatologico alla base dello sviluppo degli eventi tromboembolici venosi, come già ipotizzato da Virchow nel 1893, deriva da uno o più elementi della triade che prende il suo nome: stasi venosa, danno endoteliale e iper-coagulabilità. Anche nel paziente neoplastico, questa triade patologica rappresenta la base del meccanismo di sviluppo degli eventi trombotici, che si manifestano in conseguenza di una serie di fattori strettamente associati alla biologia del tumore, al suo effetto massa nella sede primaria o secondaria o a mediatori rilasciati dalla neoplasia. La lista completa dei possibili fattori implicati nella modifica dell’equilibrio emostatico è riportata in Tabella 1.
Tabella 1. Triade di Virchow nel paziente oncologico
Ipercoagulabilità
Per ipercoagulabilità si intende la propensione del paziente verso la formazione di trombi. Sono stati riportati diversi pathways, spesso compresenti, che conducono allo sviluppo della suddetta condizione: l’attivazione diretta della coagulazione, l’inibizione della fibrinolisi, l’aggregazione piastrinica cancro-indotta e la predisposizione ad una aumentata risposta infiammatoria, condizione strettamente correlata con lo sbilanciamento del fisiologico equilibrio tra fattori protrombotici ed antitrombotici. L’attivazione diretta della coagulazione può essere secondaria alla presenza in circolo di citochine secrete direttamente dalle cellule tumorali e dalla loro interazione con il microambiente tumorale, come il fattore tissutale (TF) e le microparticelle rivestite da fattore tissutale (MPs), il Cancer Procoagulant (CP) e le eparinasi.23 Dai più recenti studi emerge come queste molecole non solo spostino l’equilibrio emostatico in senso pro-coagulante ma siano probabilmente implicate anche in meccanismi di diffusione tumorale.23
A livello della superficie delle cellule neoplastiche vengono altresì iper-espresse molecole responsabili dell’inibizione del sistema fibrinolitico, come l’inibitore dell’attivatore del plasminogeno (Plasminogen Activator Inhibitor (PAI) 1 e 2), che destabilizza ulteriormente il precario equilibrio emostatico. L’aggregazione piastrinica è stata recentemente evidenziata nei pazienti oncologici come corresponsabile dell’aumento del rischio di sviluppo di TEV. I trombociti possono essere, infatti, attivati da alcune sostanze prodotte dalle cellule tumorali, come ad esempio l’ADP, la trombina, alcune metalloproteasi e l’interleuchina (IL)-6, inducendo la presentazione sulla loro superficie di un maggior numero di molecole di adesione (come, ad esempio, la P-selectina) responsabili di una maggiore tendenza all’aggregazione.24
Non secondario nell’incremento della coagulabilità ematica è il ruolo giocato dall’infiammazione. La massa tumorale, interagendo con il microambiente tumorale e con le cellule del sistema immunitario, genera, sia in sede tumorale sia a livello sistemico, un incremento delle proteine di fase acuta e dei mediatori dell’infiammazione. Queste modificazioni si ripercuotono sull’aumento del rilascio di molecole quali il TF, il fattore di von Willebrand (vWF), il PAI-1, il VEGF e su una concomitante riduzione dei livelli di proteina C. L’aumento in circolo di questi fattori è in grado a sua volta di incrementare lo stimolo protrombotico.25 Inoltre, l’attivazione leucocitaria indotta dall’interazione diretta con la massa, provoca un aumento dell’attività pro-trombotica attraverso l’espressione di nuove molecole di adesione a livello della superficie linfocitaria e attraverso la formazione di particelle denominate Neutrophil Extracellular Traps (NETs), un intricato reticolo di DNA esternalizzato, istoni e proteasi. Recenti studi riportano come queste formazioni sembrano facilitare l’aggregazione e la formazione trombotica, nonché compartecipare al processo di resistenza della neoplasia al sistema immunitario ed al processo di proliferazione metastatica.26
Infine, mediante numerosi mediatori pro-infiammatori, come l’IL-1b, IL-6, Tumor Necrosis Factor a (TNF-a) e lipopolisaccaridi, insieme a fattori pro-angiogenici (VEGF e Fibroblast Growth Factor (FGF)) viene a configurarsi una modifica dell’adesività endoteliale, rendendo la superfice vascolare maggiormente prona all’adesione piastrinica.27
Lo stato di ipercoagulabilità è anche derivato dalle numerose modificazioni, strutturali e bioumorali, indotte dai possibili interventi chirurgici. L’origine di queste alterazioni è multifattoriale, inclusi una sovraespressione da parte del tessuto tumorale di sostanze pro-coagulanti, un incremento nell’attivazione piastrinica e un’aumentata espressione di TF da parte dei monociti, condizionanti un aumento nella predisposizione trombotica.28,29
Anche la terapia medica di supporto può causare modificazioni in senso pro-coagulante. In particolare, l’utilizzo di agenti stimolanti l’eritropoiesi (ESA), trasfusioni di globuli rossi concentrati (RBC), trasfusioni di concentrati piastrinici e fattori stimolanti la crescita granulocitaria (G-CSF) si correla con un aumentato tasso di sviluppo di TEV. RBC e ESA possono, tramite l’aumento dei livelli di emoglobina, causare un’attivazione endoteliale e un aumento della reattività delle piastrine. Il trattamento con G-CSF, invece, è stato riportato associato ad un aumento in circolo dei livelli di fattori procoagulanti aventi un ruolo nella genesi del TEV.9,28 Infine, la terapia antineoplastica causa apoptosi cellulare e incrementa il rilascio di citochine, incrementando anche in questo caso l’espressione del TF. La terapia può altresì indurre l’aggregazione piastrinica e l’espressione di TF non solo a livello endoteliale, ma anche a livello monocito-macrofagico.9,30 Un ulteriore esempio farmacologico è rappresentato dalla terapia ormonale con tamoxifene, la quale comporta, collateralmente alla sua azione principale, una riduzione dei livelli di proteina C e antitrombina, ed uno sviluppo di resistenza della proteina C attivata.9,30
Danno endoteliale
Il danno a livello delle pareti vascolari induce una modifica morfologica e funzionale delle cellule stesse, provocando il rilascio di TF e l’attivazione dell’endotelio in senso pro-trombotico. La malattia tumorale può agire a questo livello, tramite le citochine e le metalloproteasi riversate nel torrente ematico, provocando un danno diretto a livello dell’endotelio dei vasi in vicinanza della massa. Può altresì invadere direttamente il letto vascolare esponendo la propria superficie, inducendo un maggior rilascio e attivazione del TF e costituendo una superfice ad alto potenziale trombotico.
Gli interventi chirurgici, le terapie farmacologiche e la terapia radiante possono anch’esse causare un danno diretto a livello dei vasi sanguigni. In particolare, la terapia con derivati del platino esercita un’azione dannosa diretta a livello endoteliale. Lo stesso meccanismo viene riportato anche per gli agenti anti-angiogenici come gli anti-VEGF e anti-EGFR. La terapia radiante è altresì capace di indurre danno fisico diretto a livello endoteliale, producendo simultaneamente un aumento sia del rischio trombotico sia del rischio emorragico attraverso una maggiore fragilità vasale. Infine, anche la presenza di accessi venosi stabili, come cateteri venosi centrali (CVC) e cateteri venosi centrali ad inserzione periferica (PICC), a causa del loro calibro e della loro lunga permanenza in sede, possono provocare un danno endoteliale, attivando di conseguenza i meccanismi precedentemente elencati. Inoltre, le possibili infezioni a livello dell’apice di tali cateteri, esponendo la parete batterica ricca di glicoproteine di adesione, possono costituire superfici ad alto rischio di sviluppo di apposizioni trombotiche.
Stasi venosa
La compressione esercitata dal tumore e dalle metastasi d’organo o linfonodali, può direttamente causare una alterata circolazione venosa, predisponendo ad un aumento di interazione tra i fattori procoagulanti e la parete vascolare attivata. A livello dei distretti venosi alterati a causa della compressione locale viene a realizzarsi un ambiente ipossico, predisponendo la parete endoteliale ad un incremento dell’esposizione di prostaglandine e di fattore attivante le piastrine, associati ad un aumentato rischio trombotico.27 Inoltre, gli interventi chirurgici, i ricoveri ospedalieri e il deterioramento delle condizioni generali dei pazienti, causando una riduzione della mobilità del paziente, generano anch’essi una stasi a livello del letto venoso degli arti inferiori. Una volta che il sistema emostatico è attivato, la trombina, rilasciata dalle piastrine, e i prodotti finali della fibrinolisi possono causare o aumentare il danno muscolare, perpetuando una condizione di aumentato rischio.
4. Score di rischio nella prevenzione del TEV associato a cancro
L’incidenza e l’impatto nel breve e lungo periodo degli eventi tromboembolici nei pazienti neoplastici hanno condotto alla realizzazione di modelli predittivi di rischio (risk assessment models, RAMs) volti all’individuazione dei soggetti che potrebbero giovarsi di una tromboprofilassi primaria. Nel corso degli ultimi anni, sono stati introdotti e validati diversi RAMs come il Khorana score, il VIENNA CATS score, il PROTECHT score, il CONKO score, l’ONKOTEV score e il COMPASS-CAT RAM.31 Questi strumenti si basano sull’assegnazione di un punteggio per la presenza di determinati fattori di rischio individuali, per- mettendo di suddividere la popolazione oncologica in gruppi ad alto e basso rischio di sviluppo di trombosi associata a cancro (CAT). Lo score maggiormente validato e consigliato dalle principali linee guida internazionali è quello di Khorana (Tabella 2). Un punteggio maggiore o uguale a 2 identifica i pazienti con un rischio aumentato di sviluppo di TEV.32
Tabella 2. Modelli di stratificazione di rischio (RAMs) derivati dal Khorana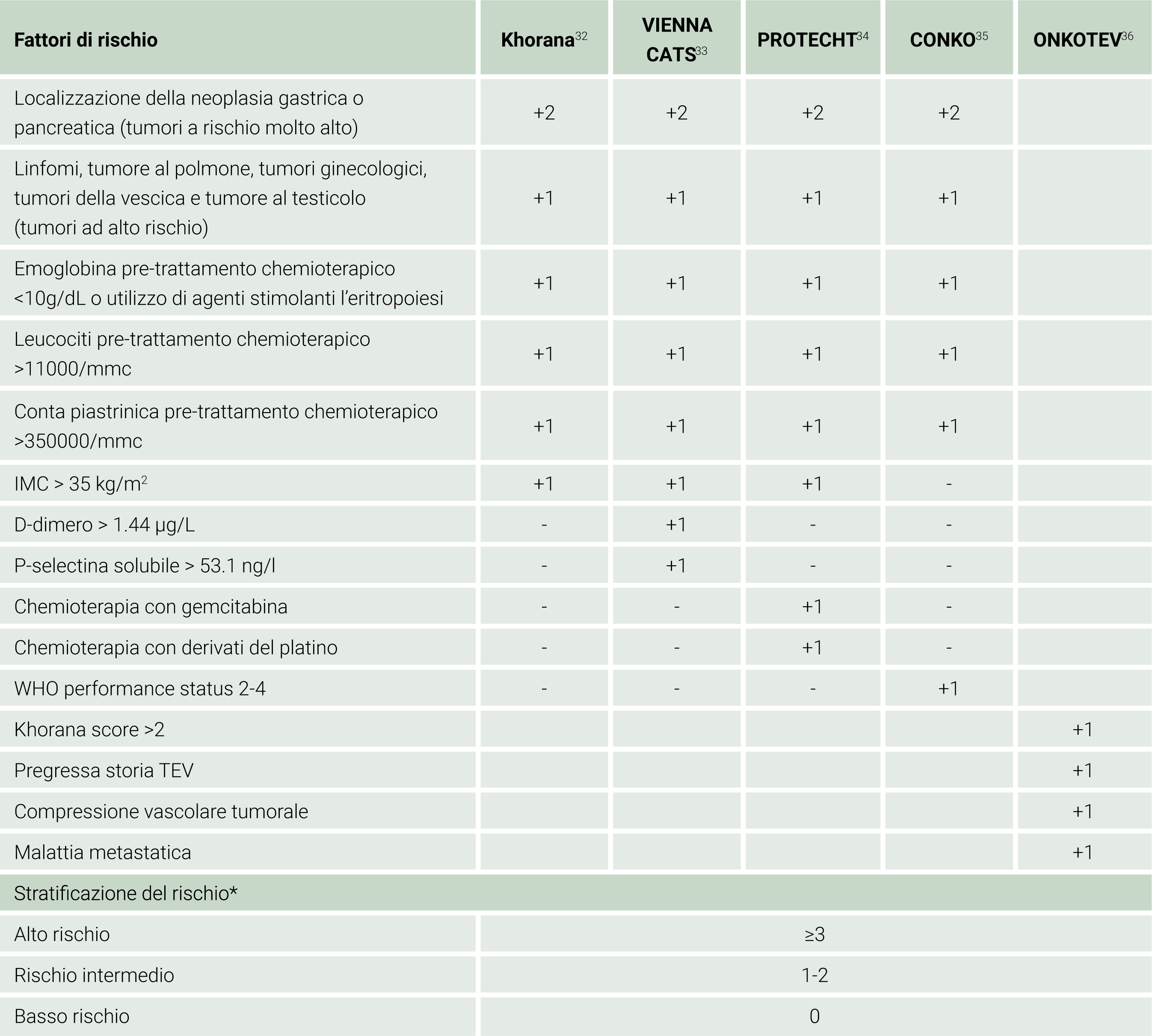 IMC: Indice di Massa Corporea; WHO: World Health Organization.
IMC: Indice di Massa Corporea; WHO: World Health Organization.
*I punteggi riportati come stratificazione del rischio corrispondono a quelli del Khorana Score.
Più recentemente, sono stati introdotti una serie di strumenti derivati dal Khorana score, con l’obiettivo di includere ulteriori criteri associati a maggior rischio di TEV non precedentemente inclusi nel modello originale (vedi Tabella 2). Sono stati inclusi criteri laboratoristici come D-dimero e P-Selectina (Vienna CATS33), il rischio associato alla tipologia della terapia oncologica somministrata (PROTECHT Score34), il punteggio ECOG (CONKO Score35) o lo stadio, storia di pregresso TEV e presenza di compressione vascolare tumorale (ONKOTEV Score36). Altri score come il COMPASS-CAT37 non hanno come base il Khorana score ma includono le comorbilità cardiologiche del paziente, l’approccio terapeutico e la progressione della patologia.
Nonostante l’utilità di questi strumenti in numerosi contesti clinici, va sottolineato come, in pazienti con stadio di neoplasia avanzato, il Khorana score, il VIENNA-CAT score, il PROTECHT score e il CONKO score non siano completamente efficaci ad individuare i pazienti ad alto rischio di sviluppo di TEV.38
5. Strategie terapeutiche in prevenzione primaria
L’ultima edizione delle linee guida dell’American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Comprehensive Cancer Network (NCCN), Initiative on Thrombosis and Cancer (ITAC) e American Society of Clinical Oncology (ASCO), raccomandano, come scelta terapeutica per la prevenzione del TEV in pazienti considerati ad alto rischio, l’utilizzo di eparina a basso peso molecolare (EBPM) o di un anticoagulante orale diretto (DOAC) a scelta tra apixaban 2,5 mg e rivaroxaban 10 mg. Le linee guida concordano altresì sull’utilità della somministrazione della profilassi farmacologica nei pazienti valutati ad alto rischio di sviluppo di TEV mediante uno dei RAMs proposti e validati, ponendo particolare accento sulla prevenzione delle complicanze trombotiche.39-42
Il beneficio netto derivante dalla somministrazione di una tromboprofilassi a base di EBPM è stato largamente confermato da diversi trial randomizzati, tra i quali lo studio PROTECHT e lo studio SAVE-ONCO.43,44
Il PROTECHT trial ha valutato l’efficacia di nadroparina nella popolazione oncologica non selezionata (non valutata tramite RAMs) confrontata con placebo. L’utilizzo dell’EBPM ha comportato una riduzione di eventi di TEV, riportando un tasso di ricorrenza dell’1.4% nel gruppo trattato con nadroparina rispetto al 2.9% del gruppo che aveva ricevuto il placebo. Similmente, lo studio SAVE-ONCO ha riportato come l’utilizzo di semuloparina comporti una simile riduzione degli eventi tromboembolici (tassi di 1.2% e 3.4% nei pazienti riceventi rispettivamente semuloparina e placebo). Una revisione sistematica della letteratura pubblicata nel 2017 ha confermato l’efficacia dell’EBPM nella prevenzione di recidiva tromboembolica, riportando una riduzione significativa dell’incidenza di TEV sintomatico (RR 0.53; 95% IC 0.38–0.75), senza un aumento significativo nel numero di sanguinamenti maggiori.45
Il risultato è stato ulteriormente confermato da una metanalisi pubblicata nel 2020, condotta su un numero di soggetti maggiore, che riporta una riduzione degli episodi di TEV del 64% nella popolazione oncologica ad alto rischio trattata con dosaggio profilattico di EBPM.30 Tuttavia, è stato evidenziato anche un aumento statisticamente significativo del rischio di sanguinamento maggiore, rendendo perciò necessaria un’attenta selezione dei pazienti per i quali la somministrazione di profilassi antitrombotica comporti un favorevole bilancio del rapporto rischio-beneficio.
L’utilizzo di un’alternativa farmacologica somministrabile per via orale è stato recentemente esplorato dai trial CASSINI (rivaroxaban) e AVERT (apixaban). Questi trial hanno arruolato pazienti indentificati ad alto rischio tromboembolico secondo il Khorana score (punteggio maggiore di 2), randomizzandoli a ricevere DOAC o placebo. Nel trial CASSINI, 841 pazienti sono stati randomizzati a ricevere rivaroxaban 10 mg o placebo una volta al giorno, riportando una riduzione degli episodi di TEV nel gruppo ricevente rivaroxaban rispetto al gruppo placebo (HR: 0.66; 95% IC, 0.40-1.09).46 La somministrazione di apixaban 2.5 mg due volte al giorno è stata invece analizzata in 574 pazienti arruolati nel trial AVERT, ottenendo una riduzione significativa degli eventi tromboembolici con un HR pari a 0.41 (95% IC, 0.26-0.65).47 Significativo risulta, tuttavia, anche il dato riportato da entrambi gli studi sull’aumento degli episodi di sanguinamento maggiore, confermando ulteriormente la necessità di un’attenta selezione dei pazienti neoplastici a cui somministrare una profilassi antitrombotica.
Una valutazione comprendente entrambe le strategie farmacologiche di profilassi è stata riportata in una metanalisi pubblicata nel 2020, che ha incluso 4662 pazienti ed ha evidenziato come, in pazienti oncologici ad alto rischio tromboembolico e con terapia oncologica attiva, l’utilizzo di una profilassi con DOAC o EBPM riduca significativamente il rischio di eventi trombotici (RR 0.51; 95% IC, 0.34-0.67; NNT 25) senza una differenza significativa nel rischio di sanguinamento maggiore (RR 1.06; 95% IC, 0.69-1.67, NNH 1000).48
6. Strategie terapeutiche per la terapia del TEV
Trattamento della fase acuta (3-6 mesi)
Le attuali principali linee guida basate sulle evidenze scientifiche suggeriscono per la prima fase del trattamento del TEV nei pazienti oncologici l’utilizzo di EBPM o di un DOAC (apixaban, rivaroxaban o edoxaban) in preferenza rispetto agli antagonisti della vitamina K (AVK).39-42,49 Le maggiori raccomandazioni sulla terapia antitrombotica in questa popolazione sono riportate nella Tabella 3.
Tabella 3. Principali linee guida per la terapia del tromboembolismo venoso associato a cancro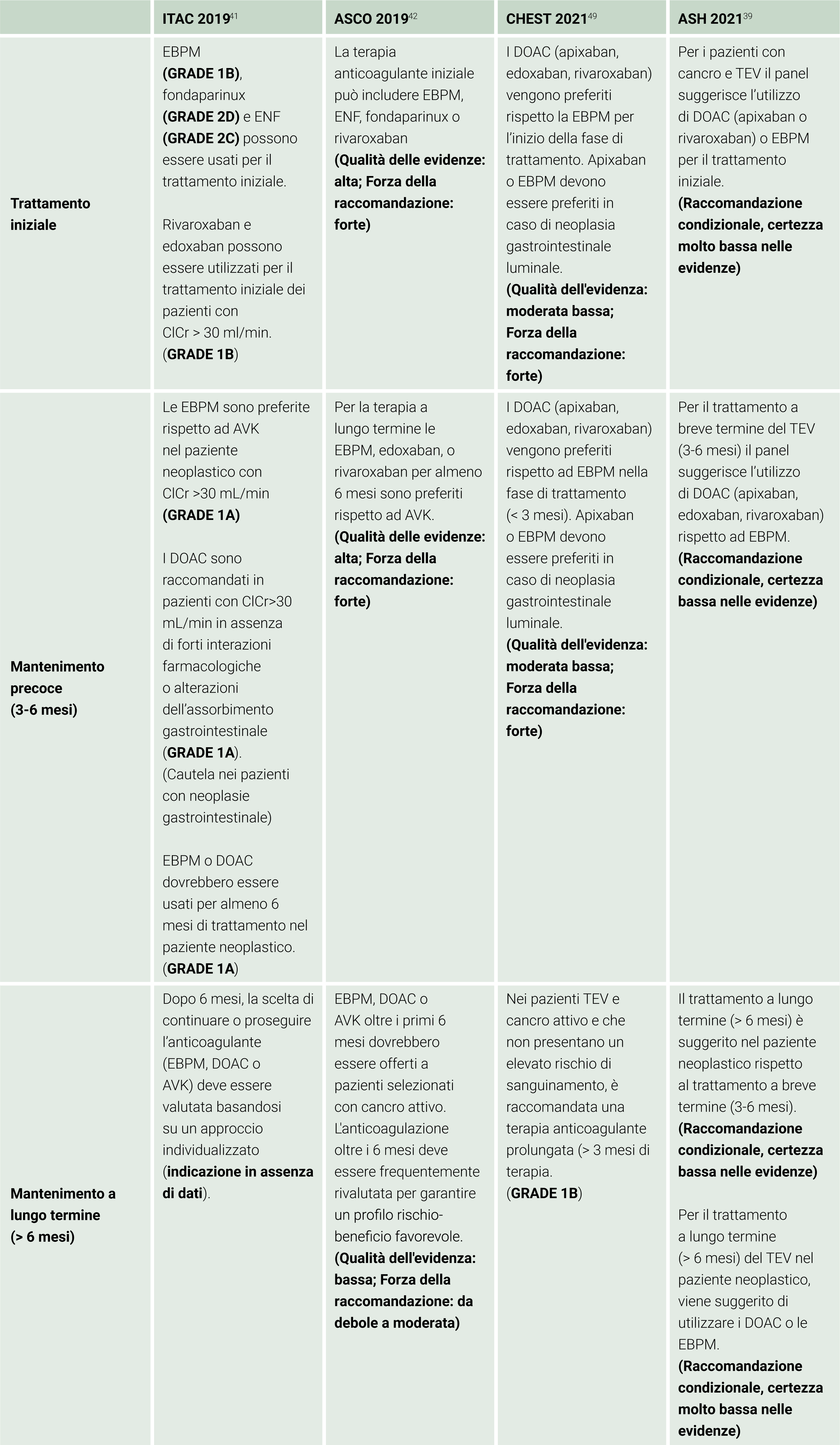 EBPM: Eparina a basso peso molecolare; GRADE: Grading of Recommendations, Assessment, Development and Evaluations; ENF: Eparina non frazionata; ClCr: Clearance della creatinina; DOAC: Anticoagulanti orali diretti; TEV: Tromboembolismo venoso; AVK: Inibitori della vitamina K.
EBPM: Eparina a basso peso molecolare; GRADE: Grading of Recommendations, Assessment, Development and Evaluations; ENF: Eparina non frazionata; ClCr: Clearance della creatinina; DOAC: Anticoagulanti orali diretti; TEV: Tromboembolismo venoso; AVK: Inibitori della vitamina K.
Tra gli inibitori diretti, edoxaban è stato il primo ad essere testato specificatamente nei pazienti con CAT nello studio HOKUSAI-VTE Cancer.50 Questo trial ha comparato edoxaban 60 mg e dalteparina 200UI/kg nel trattamento di fase acuta del TEV, riportando una non inferiorità di edoxaban nella prevenzione dell’outcome composito di recidiva trombembolica e sanguinamento maggiore (HR, 0.97; 95% IC, 0.70-1.36; p=0.006 per non inferiorità). Rivaroxaban è stato invece direttamente studiato, per la prima volta nel paziente con CAT nello studio SELECT-D, che ha dimostrato come l’utilizzo di rivaroxaban si associ ad una incidenza cumulativa di recidiva di TEV nei primi 6 mesi di trattamento del 4% contro l’11% riscontrato nel gruppo trattato con dalteparina (HR, 0.43; 95% IC, 0.19-0.99), riportando altresì un incremento non significativo del tasso di sanguinamenti maggiori (6% rispetto il 4% nel gruppo trattato con EBPM).51 Tale riscontro è stato confermato anche nello studio CASTA-DIVA, senza però raggiungere la significatività statistica.52 Infine, anche apixaban è stato sperimentato come terapia di fase acuta del TEV in pazienti oncologici nello studio CARAVAGGIO.53 In questo trial randomizzato, apixaban al dosaggio abituale di 5 mg due volte al giorno (dopo la fase di carico di 10 mg bid nei primi sette giorni) è stato comparato con dalteparina 200 UI/kg, dimostrando di essere non inferiore rispetto ad EBPM nella prevenzione delle recidive degli episodi di TEV (HR 0.63; 95% IC, 0.37-1.07; P<0.001 per non inferiorità) ed essendo associato ad una incidenza di episodi di sanguinamento maggiore non significativamente diversa rispetto ad EBPM (HR, 0.82; 95% IC, 0.40-1.69; P=0.60). Simili risultati sono stati ottenuti anche dallo studio ADAM-VTE con un numero inferiore di pazienti.54 Il trial CANVAS ha infine randomizzato 671 pazienti a ricevere un DOAC o dalteparina, evidenziando anche in questo caso una non inferiorità nell’efficacia nella riduzione del tasso di incidenza di TEV (6.1% nei pazienti trattati con DOAC e 8.8% nei pazienti che hanno ricevuto dalteparina).55 Le caratteristiche degli studi randomizzati che valutano efficacia e sicurezza dei DOAC in questo setting sono riassunti nella Tabella 4.
Tabella 4. Trial sull’utilizzo dei DOAC nel paziente neoplastico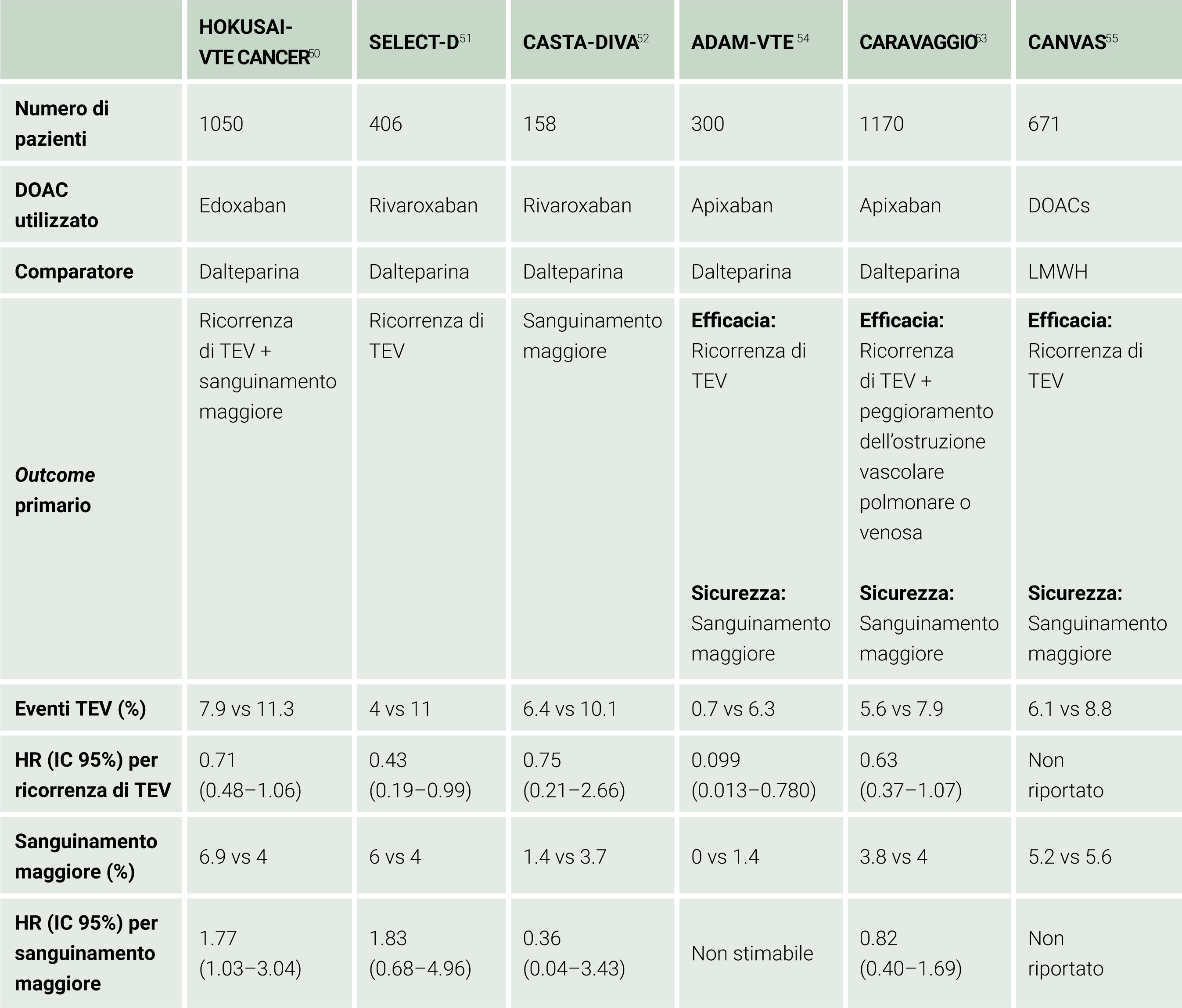 DOAC: Anticoagulante orale diretto; TEV: Tromboembolismo Venoso; HR: Hazard Ratio; IC: Intervallo di confidenza.
DOAC: Anticoagulante orale diretto; TEV: Tromboembolismo Venoso; HR: Hazard Ratio; IC: Intervallo di confidenza.
I risultati di questi studi sono stati confermati da una recente metanalisi, pubblicata nel 2022, che ha identificato una riduzione statisticamente significativa degli eventi tromboembolici legata ai DOAC rispetto ad EBPM (RR 0.67; 95% CI 0.62– 0.85) a discapito tuttavia di un aumento non statisticamente significativo del rischio di emorragie maggiori (RR 1.17; 95% IC 0.82-1.67) ed invece statisticamente significativo per i sanguinamenti clinicamente significativi non maggiori (RR 1.66; 95% IC 1.31 – 2.09). Nessun effetto è stato invece rilevato in termini di mortalità (RR 1.02; 95% IC 0.89-1.16).48 Agli stessi risultati è giunta anche una ulteriore meta-analisi pubblicato nel 2022.56
Per quanto riguarda la scelta del farmaco anticoagulante diretto, i risultati di un recente lavoro hanno evidenziato come apixaban sia risultato associato ad un ridotto tasso di sanguinamento gastroenterico.57 Nonostante ciò, i dati in letteratura provano come tutti i DOAC risultino non inferiori all’EBPM come efficacia e sicurezza nel trattamento della trombosi correlata a cancro e le principali linee guida non consigliano una preferenziale scelta di DOAC.
In caso di impossibilità di somministrazione di DOAC o EBPM, viene suggerito in ultima battuta l’utilizzo di AVK.
Numerosi sono i trial che hanno comparato le EBPM agli AVK nel trattamento di fase acuta della complicanza trombotica. Nel CLOT trial58 676 pazienti sono stati randomizzati a ricevere dalteparina o warfarin per una durata di 6 mesi di trattamento. I risultati di questo studio hanno affermato la superiorità dell’EBPM in termini di riduzioni del tasso di ricorrenza di TEV (HR 0.48; 95% IC, 0.30-0.77), senza riportare un significativo aumento del tasso di sanguinamento. Successivamente a questo studio, almeno quattro trial sono stati realizzati (CATCH59, LITE60, ONCENOX61 e Meyer et al.62), tra i quali però solo il trial LITE, che ha utilizzato tinzaparina, ha riportato un’effettiva riduzione nel tasso di incidenza di TEV. Una meta-analisi condotta dalla Cochrane Collaboration ha confermato il vantaggio dell’EBPM rispetto agli AVK sulla riduzione delle recidive di TEV (RR 0.58; 95% IC 0.43-0.77), mentre non vi sono state differenze in termini di sanguinamento maggiore e mortalità.63
Infine, sebbene considerati come ultima scelta da parte delle ultime linee guida, occorre tenere a mente anche la possibilità dell’utilizzo degli AVK. Le situazioni più frequenti nelle quali si potrebbe dover ricorrere a questi farmaci sono: l’insufficienza renale di stadio terminale (ClCr < 15 ml/min) e la scelta del paziente di rifiutare una terapia iniettiva con concomitante impossibilità alla somministrazione dei DOAC.
Infine, in caso di impossibilità dell’utilizzo di una terapia anticoagulante (ad esempio la concomitanza di un evento di sanguinamento maggiore e di TEV), deve essere presa in considerazione la possibilità di fare ricorso a dispositivi meccanici, come i filtri cavali impiantanti nella vena cava inferiore (IVCF). Il loro utilizzo dovrebbe essere però strettamente limitato ai pazienti in fase acuta con controindicazione all’assunzione di terapia farmacologica e non nei pazienti con tromboembolismo recidivante nonostante la presenza di una terapia normocondotta, alla luce anche del basso numero di filtri successivamente rimossi in questi pazienti e alle complicanze correlate alla lunga permanenza in sede.64
Prevenzione secondaria (>6 mesi)
Come precedentemente analizzato, tenuto conto dell’effetto che una neoplasia esercita sul rischio trombotico, una strategia di anticoagulazione a lungo termine viene preferita rispetto ad un trattamento di durata inferiore o uguale ai 6 mesi da parte di tutte le linee guida. Nonostante ciò, i trial presenti in letteratura non forniscono dati dopo i 12 mesi di trattamento e il rischio di sanguinamento derivante dall’assunzione della terapia anticoagulante a tempo indefinito deve essere attentamente ponderata, per la possibile esposizione del paziente ad un elevato rischio di emorragia maggiore.
La scelta primaria del trattamento prolungato ricade su EBPM o DOAC. Sebbene dal punto di vista di efficacia non vi siano sostanziali differenze, i DOAC presentano un comprovato aumento del rischio di sanguinamento maggiore e un maggior numero di interazioni farmacologiche (vedi paragrafo successivo). La scelta della tipologia di trattamento dovrebbe dunque tenere sempre in considerazione il contesto clinico, le caratteristiche del paziente, il suo rischio individuale di recidiva tromboembolica e di sanguinamento maggiore e, non per ultima, la preferenza del paziente.
Dubbia rimane ancora l’efficacia delle dosi ridotte dei DOAC (rivaroxaban e apixaban) in prevenzione secondaria di TEV nei pazienti oncologici. Un recente lavoro ha esplorato l’incidenza di ricorrenza di TEV e di sanguinamento in pazienti neoplastici trattati con dosaggio ridotto di apixaban, risultando in una bassa incidenza di eventi anche dopo i 12 mesi di trattamento (rispettivamente 7.6% e 3.1%).65 Ulteriori evidenze sono attese dalla pubblicazione dei risultati dell’EVE trial [NCT03080883] e dell’API-CAT trial [NCT03692065], che valuteranno sicurezza ed efficacia di apixaban a dosaggio ridotto dopo 6 mesi di terapia a dosaggio pieno.
7. Problematiche comuni nell’utilizzo della terapia anticoagulante nel paziente neoplastico
Rischio di sanguinamento
La popolazione affetta da patologia neoplastica è notoriamente a maggior rischio di sanguinamento e l’utilizzo di terapie anticoagulanti non fa altro che esacerbare questa propensione.5 Non sono attualmente disponibili dati in letteratura che riportino un confronto diretto tra pazienti neoplastici e non, in terapia anticoagulante, ma dai risultati dei trial condotti su AVK, EBPM e DOAC e dalle successive sotto-analisi è possibile evidenziare un aumento del rischio di sanguinamento nei pazienti con cancro attivo rispetto ai pazienti non neoplastici e ai pazienti con storia di cancro.5,66
Il rischio di sanguinamento in questa popolazione è causato sia dal cancro stesso, secondariamente all’invasione locale, alla neoformazione anomala di vasi ed alla necrosi intra-tumorale, sia in seguito ai potenziali effetti avversi della terapia (radioterapia, chemioterapia e interventi chirurgici).67 Occorre inoltre avere una particolare attenzione alla conta piastrinica, in quanto questi pazienti, soprattutto per quanto riguarda le neoplasie ematologiche e l’utilizzo di chemioterapia classica o radioterapia, incorrono più frequentemente in fenomeni di mielosoppressione.68 Una conseguente riduzione della conta piastrinica comporta dunque una ridotta aggregazione ed un correlato aumento del rischio di sanguinamento. La scelta di anticoagulanti in pazienti con una conta piastrinica inferiore a 50.000/mmc dovrebbe propendere per l’utilizzo di EBPM a dosaggio ridotto, in quanto risultata utilizzabile per valori superiori a 25.000/mmc e perché, al momento, non esistono dati significativi riguardo il trattamento con DOAC e concomitante piastrinopenia. È invece indicato di non somministrare alcuna terapia anticoagulante in pazienti con un titolo piastrinico inferiore alle 25.000/mmc.69
Interazioni farmacologiche
La gestione delle interazioni farmacologiche è altresì importante e di frequente riscontro nella pratica clinica. Il paziente oncologico viene frequentemente sottoposto a numerose linee di terapia che possono condividere gli stessi pathways di eliminazione o competere con l’assorbimento di specifici farmaci anticoagulanti.
I DOAC e gli AVK, tra i farmaci anticoagulanti, sono quelli che risentono maggiormente delle interazioni farmacologiche. Diversi meccanismi possono causare queste interazioni, sia farmacocinetiche che farmacodinamiche. È pertanto sconsigliato l’utilizzo dei DOAC in concomitanza dell’assunzione di farmaci forti inibitori della glicoproteina-P e del citocromo P450 3A4 (CYP3A4)63,69-71, in quanto principali attori del metabolismo degli inibitori del fattore Xa. Molto più complesse e difficili da prevedere sono le interazioni farmacodinamiche, in quanto dipendono maggiormente dalle caratteristiche del singolo individuo.71 Oltre al profilo farmacologico della molecola utilizzata, diversi fattori sono stati identificati per il rischio di interazioni farmacologiche come l’età avanzata, la polifarmacoterapia e la presenza di insufficienza renale.71
Per questa ragione nell’ultimo periodo sono stati introdotti degli algoritmi terapeutici che possono essere usati per la decisione nella somministrazione degli inibitori diretti o dell’EBPM. Nell’algoritmo suggerito da Carrier et al. i pazienti con cancro dell’apparato gastroenterico o uroteliale, o i pazienti in trattamento con medicinali che potrebbero causare interazioni farmacologiche con il concomitante utilizzo dei DOAC, dovrebbero essere trattati con EBPM a dosaggio terapeutico per una durata estesa di trattamento.72
Un recente studio prospettico ha analizzato il numero medio di interazioni farmacologiche riscontrate in questa popolazione, riportando come i pazienti in terapia con warfarin riportino una media di 3.04 farmaci interferenti per paziente, notevolmente maggiore rispetto ad apixaban (1.28), rivaroxaban (1.02), e EBPM (0.98). Viene inoltre riportato come per le eparine, nessuna interazione farmacologica si sia rivelata clinicamente significativa.73
Gestione perioperatoria degli anticoagulanti
Il ricorso ad interventi chirurgici o procedure invasive a scopo diagnostico e/o terapeutico è estremamente frequente nella popolazione in esame. La terapia anticoagulante deve essere correttamente gestita, tenendo conto del tipo di farmaco somministrato, della funzionalità renale del paziente e del tipo di intervento. Tafur et al. hanno dimostrato come i pazienti con eventi trombotici associati a cancro che avessero interrotto la terapia anticoagulante a causa di necessità di intervento chirurgico abbiano riportato tassi di recidiva tromboembolica maggiori rispetto ai pazienti senza cancro attivo (1.2% contro 0.2%; P = 0.001).29 Inoltre, la modifica della funzionalità renale conseguente alla patologia e il maggior numero di interazioni farmacologiche possono modificare il profilo farmacocinetico di questi farmaci, rendendo necessari aggiustamenti dei normali periodi di sospensione.
Insufficienza renale associata a cancro e terapia anticoagulante
L’insufficienza renale cronica è fortemente correlata al paziente neoplastico. Infatti, la letteratura mostra come una percentuale di pazienti tra 50.9% e l’87% presenti un valore di filtrato glomerulare (eGFR) inferiore a 90 ml/min/1,73 m2 mentre valori inferiori a 60 ml/min/1,73 m2 vengono osservati in una popolazione neoplastica tra l’11.8%-25%.74 Dal punto di vista della terapia anticoagulante, è noto come alla riduzione della funzionalità renale corrisponda un aumento del rischio di sanguinamento, in particolare di tipo maggiore. Questo è dovuto alla presenza di una riduzione dello smaltimento dei farmaci anticoagulanti, in particolare dei DOAC.
Considerata l’importante percentuale di questi farmaci nell’intraprendere la via di eliminazione renale (per apixaban, rivaroxaban ed edoxaban rispettivamente del 27%, 33% e 50%)75, il loro utilizzo deve essere valutato con cautela per valori di filtrato inferiori a 30 ml/min/1,73 m2. Mentre non sono presenti dati significativi in letteratura con i DOAC al di sotto dei 15 ml/min/1,73 m2. Uno studio osservazionale che ha analizzato l’effetto della terapia anticoagulante con AVK o EBPM nei pazienti affetti da patologia neoplastica ha identificato come quelli a maggior rischio di sanguinamento maggiore fossero i pazienti con una insufficienza renale di stadio 4 o 5 e concomitante trattamento con EBPM, consigliando cautela nell’utilizzo anche di questa molecola.76 Tuttavia, i dicumarolici, sebbene largamente utilizzati in caso di malattia renale terminale, non hanno dimostrato in questa popolazione un effettivo vantaggio in termini di efficacia e/o di sicurezza.
Patologia tromboembolica associata a catetere venoso
La frequente ospedalizzazione e la somministrazione endovenosa di terapia antitumorali necessitano spesso della presenza di un accesso venoso stabile e duraturo. L’incidenza di complicanze trombotiche catetere-correlate varia notevolmente tra le diverse coorti presenti in letteratura, passando dal 2 al 66% in popolazioni che includono anche episodi asintomatici a valori compresi tra il 2.7% e il 13.8% se si considerano solo gli eventi sintomatici.77 L’utilizzo di una tromboprofilassi in questi pazienti è stata valutata da una meta-analisi di D’ambrosio et al. che ha mostrato come la somministrazione profilattica di EBPM o di bassi dosaggi di VKA possano effettivamente ridurre il tasso di eventi tromboembolici. Nonostante ciò, data la bassa prevalenza nella popolazione oncologica generale di questa complicanza, è stato stimato un Number Needed to Treat (NNT) di 32 pazienti per prevenire una TVP sintomatica.77 Per questa ragione le principali linee guida non raccomandano attualmente la somministrazione di una tromboprofilassi farmacologica in tutti i pazienti portatori di cateteri venosi centrali. In caso di comparsa di complicanza trombotica legata al catetere venoso, se è preservato il funzionamento del dispositivo e non vi sono ulteriori ragioni che ne impongano la rimozione (es. infezioni), le linee guida non consigliano la sua rimozione. È indicata la somministrazione della terapia anticoagulante per almeno tre mesi in tutti i casi di trombosi venosa profonda legata alla presenza di CVC, anche se il presidio viene rimosso prima di tale periodo.
Recidiva tromboembolica in corso di terapia anticoagulante
Il problema della recidiva trombotica in corso di terapia anticoagulante è significativamente rappresentato nella popolazione oncologica, con tassi di recidiva aumentati di circa 3 volte rispetto alla popolazione non neoplastica. In questi casi la scelta della terapia anticoagulante corretta è tutt’ora motivo di dibattito e le principali linee guida non forniscono chiare indicazioni a riguardo. Tra le strategie più comunemente usate nei pazienti in terapia con warfarin vi è quella dell’incremento del range terapeutico da valori compresi tra 2 e 3 a valori superiori (es. 2.5-3.5 o 3-4), sebbene i dati riportati in letteratura siano ad oggi scarsi e di bassa qualità. Nei pazienti in terapia con EBPM è consigliato un incremento della dose di circa il 25%, almeno transitoriamente per un periodo di 4 settimane,78,79 e/o il passaggio da un regime in singola somministrazione ad un regime a doppia somministrazione. Per quanto riguarda i pazienti in terapia con DOAC, non sono presenti evidenze che giustifichino l’aumento del loro dosaggio in caso di recidiva (a meno che il paziente non stesse assumendo una dose ridotta in prevenzione secondaria), lasciando quindi le opzioni di passaggio ad EBPM a dose piena o aumentata del 25% oppure ad un altro farmaco anticoagulante orale.40
Tromboembolismo venoso incidentale
Non raramente accade nei pazienti oncologici che, a causa del largo utilizzo di esami di imaging, incluse le tomografie computerizzate (TC), si ponga sempre più frequentemente diagnosi di una EP o TVP asintomatica. Un ampio studio di registro ha identificato, su 9735 pazienti analizzati, un totale di 540 (5.5%) eventi riscontrati incidentalmente.80 La strategia di trattamento di questi eventi incidentali non è unanime, anche se la scelta maggiormente adottata e consigliata è quella di somministrare il trattamento anticoagulante per 3-6 mesi, nonostante l’assenza di sintomi. Occorre però tenere conto che le attuali indicazioni in questo ambito sono basate su dati di scarsa qualità e sul parere di esperti. Una meta analisi pubblicata nel 2021 ha dimostrato come i pazienti oncologici con trombosi incidentale riportino un tasso di recidiva inferiore rispetto alla controparte sintomatica (RR 0.62; 95% IC 0.44-0.87) e un egualmente aumentato tasso di sanguinamenti maggiori (RR 1.47; 95% IC 0.99-2.20).81
8. Tinzaparina: un’eparina a basso peso molecolare approvata per il trattamento e la profilassi della trombosi venosa profonda ed embolia polmonare nel paziente oncologico
Tinzaparina è una molecola derivata dell’eparina non frazionata tramite un processo di depolimerizzazione. Come altre EBPM il suo meccanismo di azione si basa sulla capacità di incrementare l’affinità dell’antitrombina per il fattore Xa e il fattore IIa, aumentandone la velocità di inibizione. La sua efficacia nel trattamento della trombosi associata a cancro è stata analizzata per la prima volta dallo studio LITE, che ha randomizzato 737 pazienti con TVP acuta a ricevere tinzaparina o warfarin per 3 mesi. I risultati riportavano una simile efficacia in entrambi i gruppi (ricorrenza di TEV 4.9% nel braccio che ha ricevuto tinzaparina e 5.7% nel braccio trattato con warfarin (Riduzione del rischio assoluto (RRA) − 0.8%; 95% CI 4.1-2.4), mentre dal punto di vista della sicurezza è emerso come i pazienti trattati con tinzaparina sviluppassero un numero significativamente minore di sanguinamenti (13% contro 19.8%, RRA − 6.8%; P = 0.11 ; RR = 0.66).60 Inoltre, all’interno di questo studio vi erano 200 pazienti oncologici, che erano stati identificati a priori e randomizzati separatamente (Main-LITE cancer).82 I risultati concernenti questa popolazione indicavano come al follow-up di 12 mesi il tasso di recidiva tromboembolica nei pazienti trattati con tinzaparina fosse minore rispetto al gruppo di pazienti in terapia con il dicumarolico, rispettivamente del 7% e del 13% (RRA − 9.0; 95% IC 21.7-0.7). Sulla scorta di questo importante risultato è stato poi condotto un più ampio trial multicentrico, che ha randomizzato 900 pazienti con cancro e TEV acuto ad assumere tinzaparina o warfarin per 6 mesi (studio CATCH).59 Il tasso di recidiva di TEV è risultato inferiore nei pazienti trattati con tinzaparina, con una differenza ai limiti della significatività statistica (7.2% per tinzaparina vs 10.5% per warfarin; HR 0.65; 95% IC, 0.41-1.03; P =0.07). Dal punto di vista della sicurezza, sebbene non vi fosse una differenza per quanto riguarda il tasso di incidenza di sanguinamento maggiore, durante i sei mesi di trattamento i sanguinamenti clinicamente significativi non maggiori si sono verificati in numero nettamente minore nel braccio ricevente tinzaparina (49 su 449 pazienti per tinzaparina vs 69 su 451 pazienti per warfarin, HR 0.58; 95% IC, 0.40-0.84).59 Le caratteristiche e i risultati dei due trial randomizzati di tinzaparina nella terapia del paziente oncologico sono riassunti nella Tabella 5.
Tabella 5. Tinzaparina vs Warfarin nel paziente oncologico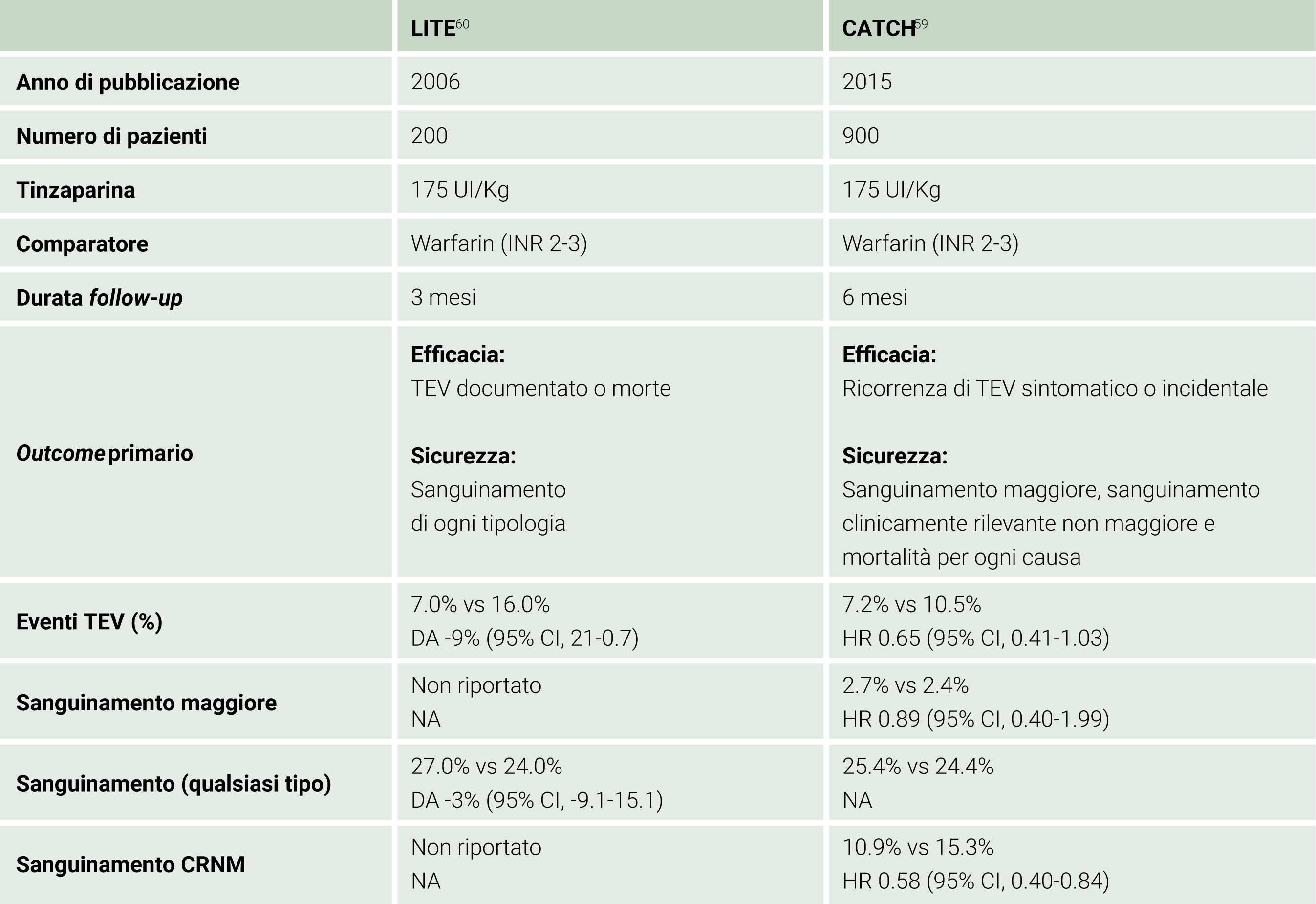 UI: Unità internazionali; TEV: Tromboembolismo Venoso; DA: Differenza Assoluta; HR: Hazard Ratio; CI: Intervallo di confidenza; NA: Non Applicabile.
UI: Unità internazionali; TEV: Tromboembolismo Venoso; DA: Differenza Assoluta; HR: Hazard Ratio; CI: Intervallo di confidenza; NA: Non Applicabile.
La differenza tra tinzaparina e warfarin è stata altresì investigata in una successiva meta-analisi di Laporte et al, che includeva, tra i 1668 pazienti analizzati, il 24% con diagnosi di neoplasia, e dimostrava, in questa popolazione, una riduzione non significativa del rischio di TEV del 38% (RR: 0.62: p=0.21) a 3-6-mesi, che incrementava fino al 59%, al limite della significatività statistica, a 12 mesi (RR: 0.41: p=0.08).83
Ulteriore conferma deriva anche da una metanalisi di Martínez-Zapata et al. che, analizzando 3 trial di confronto tra tinzaparina e dicumarolici, giungeva a simili conclusioni. Dopo un’analisi degli studi LITE, CATCH e della sottopopolazione dello studio di Romera et al.84 veniva riportata una riduzione del tasso di recidiva di TEV (RR 0.67; 95% CI 0.46-0.99) senza un’effettiva differenza nel numero di sanguinamenti maggiori.85
Lo studio TiCAT ha invece analizzato l’efficacia e la sicurezza del trattamento con tinzaparina nella profilassi secondaria dopo i 6 mesi di trattamento iniziale. Il tasso di sanguinamenti clinicamente rilevanti è stato identificato nello 0.9% dei pazienti nei primi 6 mesi e nello 0.6% dei pazienti nel periodo compreso fra 7 e 12 mesi, mentre il tasso di ricorrenza del TEV è stato del 4.5% durante il primo periodo e 1.1% nei 6 mesi successivi.86,87
Tuttavia, l’utilizzo di una terapia a base di tinzaparina anche a lungo termine è stato sperimentato come trattamento domiciliare nello studio Home-LITE88, in cui 478 pazienti sono stati randomizzati a ricevere tinzaparina o warfarin per 1 anno, riportando un simile rischio di recidiva tromboembolica e di sanguinamento maggiore, ma con una netta preferenza del farmaco parenterale da parte del paziente. Dai dati compilati dai pazienti al termine di trattamento, infatti, ove si chiedeva di esprimere un grado di soddisfazione rispetto alla terapia praticata, la maggior parte dei pazienti ha espresso valutazioni più favorevoli verso la terapia iniettiva (P=0.024).
Un ulteriore vantaggio nell’utilizzo di questa molecola risiede nel favorevole profilo farmacocinetico in pazienti con insufficienza renale. Come precedentemente citato, i pazienti oncologici hanno una maggior prevalenza di riduzione della filtrazione glomerulare, rendendo spesso necessario l’aggiustamento della dose della terapia anticoagulante. Una recente metanalisi ha riportato come i pazienti con insufficienza renale e cancro, trattati con tinzaparina, abbiano dimostrato una riduzione significativa degli eventi di sanguinamento maggiore se comparati coi pazienti in terapia con warfarin89, dimostrando la sicurezza di questa molecola in una popolazione ad alto rischio di emorragie. Inoltre, quando comparata con enoxaparina, tinzaparina ha dimostrato di non accumularsi in maniera statisticamente significativa.90
Recentemente, studi in-vitro hanno dimostrato come tinzaparina abbia anche un’attività anti-angiogenetica e anti-metastatica. Questa azione viene esplicata attraverso le proprietà della molecola di inibire l’angiogenesi, il fattore tissutale e l’abilità di ridurre la chemioresistenza.90 Sebbene i dati siano ancora sperimentali, Karamouzis et al. hanno dimostrato in una recente metanalisi come, in pazienti con diagnosi di neoplasia pancreatica avanzata, la somministrazione di tinzaparina sia correlata ad un aumento del 39.5% del periodo libero da malattia, rispetto alla popolazione che non ha ricevuto il farmaco.91
Occorre infine ricordare che, nel contesto italiano, tinzaparina sia attualmente l’unica EBPM, insieme ad uno dei farmaci biosimilari di enoxaparina, a presentare in scheda tecnica l’indicazione specifica per il trattamento del TEV nel paziente oncologico, sia per la fase acuta sia per il trattamento a lungo termine.
9. Gestione territoriale del tromboembolismo associato a patologia oncologica
Un punto estremamente importante della gestione territoriale della patologia oncologica è rappresentato dalla necessità di fornire informazioni ai pazienti circa la possibile sintomatologia provocata dallo sviluppo del TEV e la frequenza con cui questo si può presentare nella popolazione oncologica. Un recente studio europeo ha dimostrato come solo il 28% della popolazione con diagnosi di neoplasia fosse consapevole dell’aumentato rischio di sviluppare EP o TVP.92 Per questa ragione, la creazione di programmi territoriali di sensibilizzazione riguardo la problematica tromboembolica sono attualmente desiderabili, in quanto non solo comportano un maggiore tasso di identificazione precoce dei pazienti a rischio, ma risultano in una migliore adesione terapeutica. È stato dimostrato da uno studio spagnolo92 come esperire un evento di TEV possa compromettere ulteriormente la qualità di vita della popolazione oncologica ed è altresì nota la correlazione di questi eventi con un maggior rischio di sviluppo di malattia da stress post traumatico.
La complessità del quadro clinico, anche dal punto di vista psicologico, necessita quindi di una costante attenzione da parte dei medici curanti. Negli ultimi anni, grazie allo sviluppo di una maggiore consapevolezza generale riguardo la patologia trombotica e alla possibilità di utilizzare varie opzioni farmacologiche per la profilassi primaria e secondaria, i medici di medicina generale, i medici esperti in trombosi ed emostasi ed i medici oncologi sono chiamati ad optare per la strategia più adatta per il paziente, sentiti il suo parere e preferenze, che possono anche variare nel corso del tempo. Come dimostrato da una meta-analisi pubblicata nel 2020 riguardo la scelta della tipologia di anticoagulante, per la maggior parte dei pazienti il trattamento iniziale del TEV è a base di eparina, mentre nei 3 mesi dopo la dimissione ospedaliera una quota significativa dei pazienti (40.5%) intraprende un trattamento orale.93
Un’attenta pianificazione del percorso di questi pazienti è fondamentale per la corretta gestione e prevenzione di questa complicanza. Un esempio di come un approccio multidisciplinare possa migliorare la gestione extraospedaliera è riportata nello studio VTE-PACC.94 In questo lavoro è stato implementato un programma che coordinava l’intervento di infermieri, farmacisti, ematologi e oncologi, volto al miglior inquadramento del paziente oncologico. Con questo metodo, gli autori sono riusciti a identificare i pazienti ad alto rischio di sviluppo di complicanza trombotica, fornendo così a questa popolazione ulteriore materiale educazionale. Così facendo è stato riportato un incremento del tasso di valutazione del rischio da meno del 5% a più del 95%, incrementando l’attenzione della popolazione neoplastica riguardo questa tematica.
Nel contesto italiano, le Case di comunità, recentemente istituite, potrebbero rappresentare un contesto ideale per l’attuazione dell’approccio multidisciplinare. In particolare, questi luoghi rappresenterebbero un’importante sede di reperimento di informazioni da parte del paziente e un punto di incontro dei diversi specialisti implicati nel follow-up della complicanza trombotica. Seppur non sia ancora dimostrato se la decentralizzazione della forza lavoro medico-infermieristica possa effettivamente incrementare la salute collettiva, e attualmente non sono presenti in letteratura dati specifici a riguardo, l’importanza di questa opportunità per il paziente neoplastico dovrebbe essere colta in un tentativo di attuazione di valutazioni extraospedaliere integrate, che potrebbero modificare in modo significativo la gestione di un così delicato e complesso gruppo di pazienti.
10. Conclusioni
Analizzando globalmente la complessità della complicanza tromboembolica nel paziente oncologico, risulta subito chiara l’ampiezza del problema. In questa popolazione, non solo il TEV è estremamente rappresentato, ma, una volta diagnosticato, l’iter diagnostico-terapeutico risulta complesso e variabile. Pertanto, è di fondamentale importanza il riconoscimento precoce dei pazienti ad alto rischio, e la successiva valutazione di una profilassi farmacologica per prevenire le importanti sequele del TEV. Vista la complessità e la fragilità del malato oncologico, un punto focale nella gestione della terapia anticoagulante deve essere rappresentato dalla rivalutazione frequente del paziente. Durante il follow-up devono essere analizzate tutte le modifiche nei fattori di rischio del paziente, con particolare attenzione allo stato di salute generale, alla terapia antineoplastica in atto e all’evoluzione della patologia neoplastica. Il paziente deve essere adeguatamente informato della possibilità della complicanza tromboembolica e, in caso di sviluppo di TEV, seguito dalla diagnosi al follow-up, fornendo il massimo supporto multidisciplinare. Infatti, la gestione dei pazienti oncologici con TEV dovrebbe essere presa in carico da un gruppo di professionisti, con esperienza nel settore ed orientati ad una gestione globale del paziente, che miri a migliorarne gli outcome clinici, la qualità di vita e a ridurre il tasso di ospedalizzazione, grazie anche alla scelta delle terapie antitrombotiche più adatte, efficaci, sicure e meno interferenti con altri trattamenti.
Si ringrazia LEO Pharma S.p.A. per il contributo incondizionato


Lascia un commento