Lo studio CONFIDENCE
Nel panorama della gestione del paziente con Malattia Renale Cronica (CKD) e Diabete Tipo 2 (T2D), l'inerzia terapeutica è spesso il nemico numero uno. Per anni è stato seguito un approccio "a gradini": ottimizzare il controllo glicemico, avviare l’inibitore del sistema renina-angiotensina (RASi), titolare il RASi, attendere, valutare, aggiungere un secondo farmaco, sorvegliare l’evoluzione. Lo studio CONFIDENCE, recentemente pubblicato sul New England Journal of Medicine1, scardina questo paradigma e dimostra che iniziare simultaneamente un co-trasportatore sodio-glucosio 2 (SGLT2)-inibitore (Empagliflozin) e un antagonista non steroideo del recettore dei mineralocorticoidi (Finerenone) offre una protezione d'organo nettamente superiore e sicura, rispetto alle singole monoterapie. L’obiettivo dello studio CONFIDENCE è stato infatti valutare l'efficacia e la sicurezza dell'avvio simultaneo di Finerenone ed Empagliflozin rispetto alle singole monoterapie in pazienti con CKD e T2D.
Si tratta di uno studio multicentrico, internazionale, randomizzato, in doppio cieco, su oltre 800 pazienti affetti da T2D con un tasso di filtrazione glomerulare stimato (eGFR) di 30-90 ml/min/1,73m² e albuminuria/creatininuria (UACR) di 100-5000 mg/g (estremi del range inclusi), già in trattamento con ACE-inibitori o sartani (ARB). I pazienti sono stati divisi in tre bracci: Finerenone monoterapia, Empagliflozin monoterapia, o combinazione di entrambi.
L’endpoint primario di efficacia dello studio era valutare l'effetto combinato dei farmaci rispetto alle monoterapie sulla riduzione dell’UACR a 180 giorni. Gli endpoint secondari di efficacia miravano a valutare l'effetto e l'entità della risposta: variazione post-trattamento (variazione relativa dell'UACR tra la visita di fine trattamento, giorno 180 e 30 giorni dopo la fine del trattamento); variazione complessiva post-trattamento (variazione relativa dell'UACR tra il basale e 30 giorni dopo la fine del trattamento); risposta per soglie specifiche (riduzione relativa dell'UACR secondo soglie predefinite: >30%, >40% o >50% a 180 giorni). Lo studio prevedeva anche alcuni endopoint secondari di sicurezza come la variazione di eGFR dal basale al giorno 30 e la sua reversibilità dopo l'interruzione del farmaco, il danno renale acuto, l’iperkaliemia, l’ipotensione sintomatica, la chetoacidosi, l’ipoglicemia e le infezioni micotiche genitali.
Il CONFIDENCE ha dimostrato che la terapia combinata Finerenone ed Empagliflozin non solo è risultata superiore ma sinergica, determinando a 6 mesi dall’avvio una riduzione media dell'UACR del 52% (29% in più rispetto al solo Finerenone e 32% in più rispetto al solo Empagliflozin). Anche la sicurezza è risultata migliorata dalla combinazione Finerenone ed Empagliflozin: l'Empagliflozin ha infatti mitigato il potenziale rischio di iperkaliemia da Finerenone.
Il ruolo cruciale dell’albuminuria
È noto che la riduzione dell'UACR non è un semplice miglioramento di un parametro biochimico, ma un predittore validato di sopravvivenza renale. Metanalisi di trial clinici hanno stabilito che una riduzione del 30% dell'UACR si associa a una diminuzione del 27% del rischio di endpoint renale composito (insufficienza renale terminale, raddoppio della creatinina o eGFR <15 ml/min/1,73m²)2. Il dato di una riduzione media del 52% (ben oltre la soglia del 30%) a 6 mesi nel braccio di combinazione dello studio CONFIDENCE, suggerisce che questo approccio offre la massima probabilità di ritardare o prevenire l'ingresso in dialisi rispetto alle monoterapie. Inoltre, il fatto che già entro le prime 2 settimane di avvio della terapia combinata, la riduzione dell’UACR raggiunga il 30%, indica un’azione rapida di “salvataggio dei nefroni” caratterizzata da una riduzione precoce dell’iperfiltrazione glomerulare e del tempo di esposizione tubulo-interstiziale al danno tossico della proteinuria.
L'albuminuria è inoltre un marker di disfunzione endoteliale sistemica. La sua riduzione è considerata un indicatore degli effetti protettivi sia degli SGLT2-inibitore che del Finerenone sugli eventi cardiovascolari (CV) ed elevati valori di albuminuria sono associati nei pazienti con T2D a morte CV, ipertensione, malattia renale cronica e scompenso cardiaco3. Le evidenze dello studio CONFIDENCE, pertanto, rafforzano in modo sostanziale gli Standards of Care dell'American Diabetes Association (ADA)4 che suggeriscono la misurazione seriata dell’UACR, non solo per porre diagnosi di CKD in T2D ma anche per guidare le scelte terapeutiche (come l'avvio della combinazione Finerenone + SGLT2-inibitore) contrastando l’inerzia clinica e per mirare alla riduzione del 30%, target da raggiungere per ottimizzare gli effetti protettivi renale e CV.
La nuova era della collaborazione nefro-diabetologica anche alla luce dei risultati dello studio CONFIDENCE
Per decenni, la gestione del paziente diabetico e quella del paziente nefropatico ha viaggiato su binari paralleli, incrociandosi spesso troppo tardi, quando il danno d'organo era ormai irreversibile. Oggi, i risultati dello studio CONFIDENCE (ma anche i precedenti studi di fase III condotti con Finerenone FIGARO-DKD5 e FIDELIO-DKD6) impongono un cambio di paradigma radicale: non più una staffetta ma un'alleanza tattica immediata per una "doppia difesa" renale.
Il ruolo del diabetologo
Alla luce delle nuove evidenze, il diabetologo non è più solo il custode della glicemia, ma il primo garante della salute renale, grazie alle armi a sua disposizione che possono cambiare la storia naturale della malattia. La finestra di opportunità per salvare il rene si apre nell'ambulatorio di Diabetologia. Il paziente con T2D e CKD iniziale è spesso asintomatico. Qui il ruolo del diabetologo è cruciale: deve intercettare il rischio renale del paziente diabetico e la determinazione della sola creatinina sierica (eGFR) non basta. È mandatorio eseguire sistematicamente il controllo della UACR: il biomarcatore più precoce di danno endoteliale e renale. Lo studio CONFIDENCE ha arruolato pazienti con UACR ≥ 100 mg/g, ma le linee guida suggeriscono attenzione già sopra i 30 mg/g7. La determinazione dell’UACR è fondamentale non solo per la diagnosi; il suo monitoraggio nel tempo è anche l'unico modo per valutare la risposta alla terapia. L’altro esame irrinunciabile che il diabetologo deve eseguire e interpetrare è la potassiemia sierica, fondamentale per gestire in sicurezza le nuove terapie combinate.
In base al compenso metabolico, ma anche al quadro renale del suo paziente T2D, sarà il diabetologo a dover agire precocemente utilizzando tutte le armi in suo possesso, i suoi “fantastici quattro”, con l’obiettivo di colpire simultaneamente i tre driver della progressione CKD: emodinamico, metabolico e infiammatorio/fibrotico.
- ACE-Inibitori o Sartani (RASi): la terapia di base. Nello studio CONFIDENCE, il 98,4% dei pazienti era già in terapia massimale con questi farmaci. Regola d'oro: non sospendere, ma ottimizzare.
- SGLT2-inibitori: per ridurre l'iperfiltrazione glomerulare e proteggere il cuore.
- MRA Non Steroidei (nsMRA) → Finerenone: per bloccare l'iperattivazione del recettore mineralocorticoide, spegnendo infiammazione e fibrosi.
- Glucagon-like peptide-1 Receptor Agonist (GLP1-RA): sebbene non oggetto primario dello studio CONFIDENCE, sono stati usati dal ~23% dei partecipanti e hanno un ruolo importante non solo sul controllo del peso e la protezione dal rischio CV aterosclerotico, ma anche sulla protezione renale, come dimostrato dalla semaglutide iniettiva nello studio Flow8.
Il ruolo del nefrologo
Alla luce delle evidenze innovative emerse dai recenti studi, ed in particolare dal CONFIDENCE, il nefrologo assume un ruolo strategico ed agisce non come consulente “spot” ma come specialista inserito in un team multidisciplinare che, a seconda del quadro clinico del paziente, potrà diventare il “case manager” prevalente del paziente. Il nefrologo, infatti, affiancherà il diabetologo abbandonando il vecchio ruolo di colui che “toglie i farmaci” in considerazione dei livelli di creatinina per il rischio di tossicità (es. metformina) o per l’iperpotassiemia, ma apportando la sua competenza per trasformare questo rischio da barriera insormontabile a parametro gestibile, anche tramite l’uso proattivo dei nuovi leganti del potassio (Patiromer, zirconio ciclosilicato) che permettono di mantenere in terapia con nsMRA e RASi anche pazienti a cui prima sarebbero stati sospesi, garantendo loro la protezione cardio-renale.
Inoltre, in un ambulatorio condiviso col diabetologo, il valore aggiunto del nefrologo è il sospetto clinico. Non sempre tutta la proteinuria nel diabetico è imputabile solo alla nefropatia diabetica. In letteratura, su casistiche bioptiche, sono riportate proporzioni anche elevate di pazienti diabetici con danno renale dovuto ad una Non-Diabetic Kidney Disease o una forma mista9. Le competenze specifiche del nefrologo diventeranno dirimenti nell'intercettare i segni di atipicità clinica: l'assenza di retinopatia diabetica concomitante, un declino del eGFR con cinetica accelerata (>5 ml/min/anno), il riscontro di sedimento urinario attivo, l'insorgenza repentina di proteinuria in range nefrosico o la presenza di alterazioni dell’assetto immunologico. In questi casi, il nefrologo guiderà il percorso verso la biopsia renale, consentendo che, per esempio, un paziente con una glomerulonefrite trattabile con terapie specifiche venga riconosciuto precocemente e non etichettato genericamente come "nefropatico diabetico".
Quando, nonostante le migliori cure, la malattia renale del paziente diabetico progredisce, l'integrazione diabetologo-nefrologo sarà comunque cruciale per la gestione del passaggio alla fase pre-dialitica con indicazioni da parte del nefrologo relative a:
- Gestione della terapia conservativa (dieta ipoproteica), dell'anemia (uso tempestivo degli agenti stimolanti l'eritropoiesi) e del metabolismo minerale (controllo del PTH e della fosforemia) che partecipano alla protezione del rischio cardiovascolare del paziente diabetico in insufficienza renale avanzata.
- Timing del trapianto: obiettivo sarà, ove possibile, inserire il paziente in lista attiva al momento giusto (preferibilmente trapianto da vivente preventivo), coordinandosi con il diabetologo per l'ottimizzazione metabolica pre-chirurgica.
- Scelta del trattamento dialitico più adatto al paziente (dialisi peritoneale e emodialisi).
- Preservazione del patrimonio vascolare: il nefrologo istruisce il team a non utilizzare il braccio non dominante per prelievi venosi, preservandolo per una futura fistola artero-venosa.
Una nuova frontiera: l’ambulatorio condiviso cardionefrometabolico (CNM)
La CKD nel diabete è una "epidemia silenziosa": asintomatica fino agli stadi avanzati, costosa da gestire e ad elevato impatto assistenziale per la prognosi cardiovascolare. Il modello tradizionale, basato sull'invio del paziente al nefrologo solo quando il filtrato crolla (eGFR <30 ml/min), è obsoleto. L’obiettivo di una medicina moderna proattiva è quello di creare setting multidisciplinari e multiprofessionali moderni come l’ambulatorio “Cardio-Nefro-Metabolico (CNM) territoriale” il cui fine ultimo non è centralizzare la patologia, ma diffondere la competenza e individuare, a seconda della condizione del paziente, il “case manager prevalente e dinamico” all’interno dell’equipe medico-infermieristica. Per la protezione renale del paziente diabetico il cuore dell'ambulatorio non sarà il singolo specialista, ma il processo. In una diabetologia territoriale, il primo attore è il team medico-infermieristico che ha in carico il paziente diabetico.
Pertanto:
- Ogni paziente diabetico che accede al servizio dovrà avere, prima della visita medica, il calcolo del eGFR e, soprattutto, la determinazione dell'UACR. Altro esame irrinunciabile sarà la determinazione della potassiemia.
- Il paziente dovrà essere mappato sulla griglia di rischio KDIGO (Statificazione KDIGO, Figura 1) e riferito prevalentemente al Diabetologo (riquadri verde e giallo) o al Nefrologo (riquadri arancione e rosso)9.
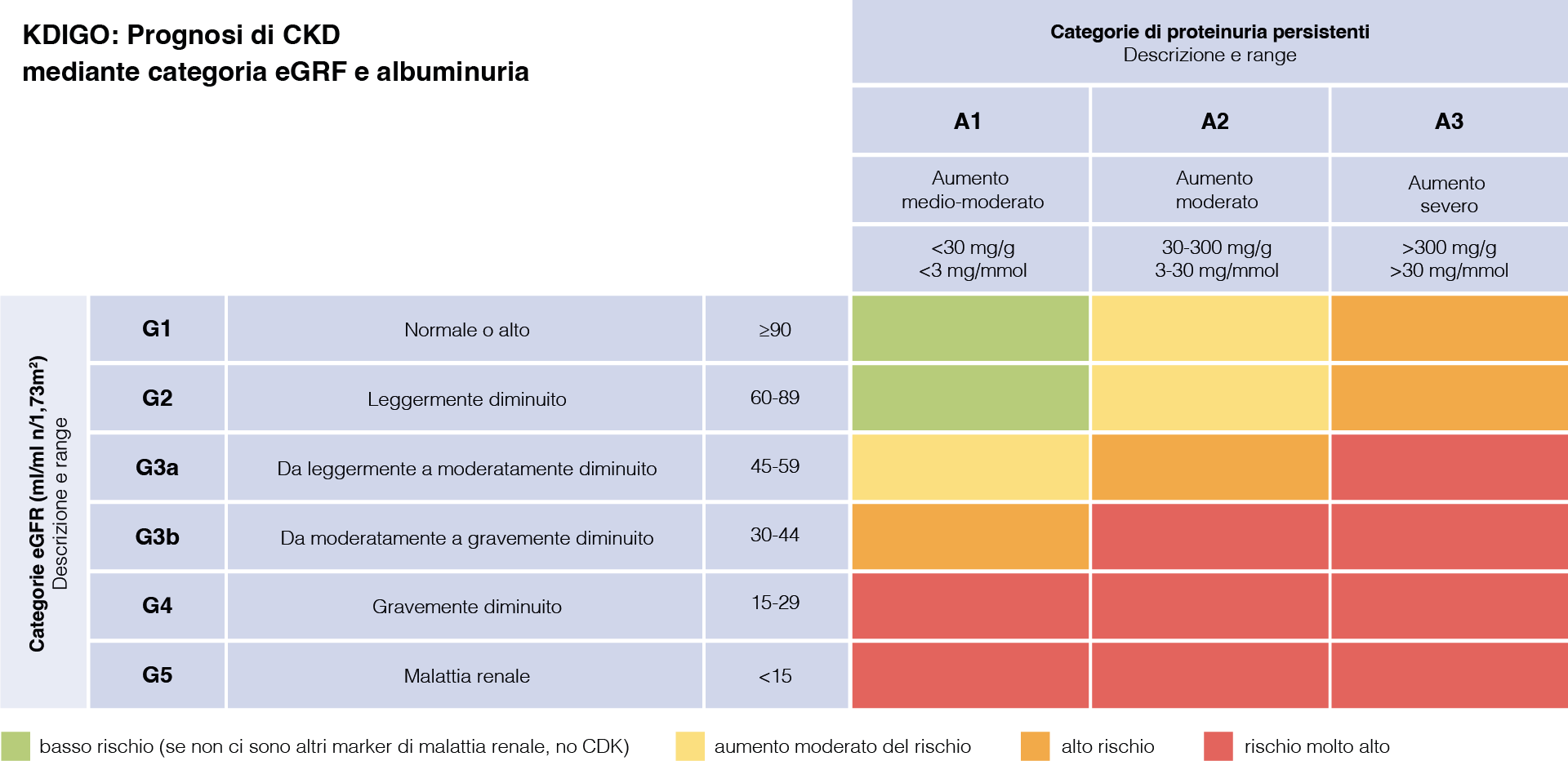 Figura 1: Stratificazione del rischio della Malattia Renale Cronica sec. KDIGO9
Figura 1: Stratificazione del rischio della Malattia Renale Cronica sec. KDIGO9
L’Integrazione Multidisciplinare: "Il Paziente al Centro, gli Specialisti Intorno"
Non spostiamo il paziente, spostiamo le competenze. Qui si inserisce il concetto chiave della gestione moderna: se i diversi specialisti si confrontano, avremo maggior appropriatezza prescrittiva, maggior aderenza terapeutica da parte del paziente e, di conseguenza, maggiori probabilità di raggiungere gli obiettivi di cura, sia per il diabete, sia per tutte le sue complicanze. Per rendere operativa questa visione, l'ambulatorio CNM dovrebbe utilizzare due strumenti:
1. Il Teleconsulto tra specialisti: il diabetologo non invia una richiesta generica, ma condivide il caso clinico complesso (es. paziente con eGFR 45ml/min/1,73m² e iperpotassiemia lieve fino a K ≤5,5mEq/l) con il nefrologo tramite piattaforma digitale. • Esempio: il nefrologo suggerisce l'aggiustamento terapeutico (es. avvio Finerenone + legante K+) senza che il paziente debba prenotare una nuova visita esterna. Questo, come noto, contribuisce a diminuire le liste d’attesa e riduce la frammentarietà del percorso.
2. L'Ambulatorio Congiunto in presenza: una sessione mensile/settimanale dove nefrologo e diabetologo vedono insieme i casi "borderline" o ad alta complessità.
Il coordinamento riduce drasticamente il rischio di polifarmacoterapia incongrua. Spesso il paziente diabetico assume farmaci ridondanti prescritti da mani diverse e in setting diversi. Nel modello integrato, si attua la Riconciliazione Farmacologica (secondo la Raccomandazione Ministeriale n. 17)10: una "cintura di sicurezza" che impedisce che terapie sofisticate vengano perse, duplicate o assunte in modo errato nel passaggio tra ospedale, ambulatorio e domicilio, aumentando la sicurezza e garantendo l’utilizzo appropriato dei farmaci “pilastro” della protezione d'organo (SGLT2i, GLP1-RA, nsMRA, RASi), ottimizzandone la spesa. Il paziente, percependo un messaggio univoco da parte del team, sviluppa una maggior aderenza terapeutica, sentendosi preso in carico da una squadra e beneficiando delle cure migliori in modo più semplice e rapido.
La creazione di questo ambulatorio deve essere vista anche come un investimento a medio termine con un Return on Investment (ROI) elevatissimo:
- Il costo della dialisi: un paziente in emodialisi costa al SSN circa 35.000 - 45.000 euro/anno, senza contare i costi sociali (invalidità, trasporto, ospedalizzazioni), 15.000-20.000 euro/anno in dialisi peritoneale.
- Il costo della prevenzione: il costo annuale di una terapia combinata con farmaci innovativi è nettamente inferiore rispetto al costo del trattamento sostitutivo dialitico (circa 3.500 euro/anno)11.
L'investimento di risorse necessario per la gestione di un ambulatorio CNM si ripaga semplicemente evitando o ritardando la progressione verso la malattia renale terminale di una piccola percentuale di pazienti assistiti.
Conclusioni
Le evidenze emerse dallo studio CONFIDENCE segnano un passaggio netto dalla gestione sequenziale alla protezione renale precoce e simultanea nel paziente con diabete tipo 2 e malattia renale cronica. L’avvio combinato di Empagliflozin e Finerenone, su background di blocco del RASi, si è dimostrato superiore alle singole monoterapie nel ridurre in modo rapido, marcato e sostenuto l’albuminuria, con un profilo di sicurezza favorevole. Il dato di una riduzione media dell’UACR del 52% a sei mesi, ampiamente oltre la soglia prognostica del 30%, rafforza il valore dell’albuminuria non solo come marker di danno, ma come vero target terapeutico modificabile.
Questi risultati hanno implicazioni cliniche dirette. Ridurre precocemente e in modo significativo l’albuminuria significa intervenire sui meccanismi patogenetici centrali della progressione della CKD, limitando l’iperfiltrazione glomerulare, l’infiammazione e la fibrosi, e riducendo contestualmente il rischio cardiovascolare. Lo studio CONFIDENCE dimostra inoltre che l’approccio combinato non aumenta la complessità gestionale, ma anzi consente una migliore maneggevolezza del rischio di iperkaliemia, superando una delle principali barriere storiche all’intensificazione terapeutica.
Alla luce di queste evidenze, l’inerzia clinica non è più giustificabile. La finestra di opportunità per modificare la storia naturale della nefropatia diabetica si colloca nelle fasi iniziali della malattia, quando il paziente è spesso asintomatico e la funzione renale ancora preservata. In questo contesto, la misurazione sistematica e il monitoraggio seriale dell’UACR diventano strumenti decisionali centrali, al pari dell’eGFR e della potassiemia, guidando l’introduzione tempestiva delle terapie cardine della protezione d’organo.
I risultati del CONFIDENCE rafforzano anche la necessità di un cambio di modello organizzativo. La gestione integrata nefro-diabetologica, idealmente inserita in un percorso cardionefrometabolico strutturato, consente di tradurre più efficacemente le evidenze in pratica clinica, migliorando appropriatezza prescrittiva, aderenza terapeutica e sostenibilità del sistema. L’approccio multidisciplinare non rappresenta un’opzione aggiuntiva, ma la naturale evoluzione di una medicina che mira a prevenire il danno d’organo prima che diventi irreversibile.
In sintesi, lo studio CONFIDENCE non aggiunge semplicemente un nuovo dato alla letteratura, ma fornisce una chiara indicazione operativa: nel paziente con T2D e CKD, la protezione renale deve essere precoce, combinata e guidata dalla riduzione dell’UACR. Integrare queste evidenze nella pratica quotidiana significa spostare l’obiettivo dalla gestione della progressione alla preservazione attiva della funzione renale, con benefici concreti per il paziente e per il sistema sanitario.


Lascia un commento