La sclerosi multipla (SM) è una malattia demielinizzante infiammatoria e neurodegenerativa, cronica e ad elevata complessità del sistema nervoso centrale, con prevalenza globale stimata per il 2020 di > 2,8 milioni di casi.1
I sintomi della SM di solito compaiono negli adulti tra i 20 e i 50 anni di età e comprendono affaticamento, disabilità visiva, debolezza motoria, atassia, mobilità ridotta, tremore, alterazioni della sensibilità, dolore, compromissione della funzione genitourinaria, depressione, e deterioramento cognitivo.2 Questi sintomi hanno un impatto negativo sulla qualità della vita dei pazienti (QoL) interferendo con il mondo lavorativo, relazioni interpersonali, la sfera intima, le attività ricreative e altre attività quotidiane.3,4
Per la maggior parte dei pazienti con SM prevale il decorso recidivante remittente5, caratterizzato da una fase iniziale di episodi neurologici (recidive) seguiti da remissione. A questa fase che caratterizza l’esordio e in genere i primi 20 anni di malattia segue una seconda fase consistente nel progressivo accumulo di disabilità neurologica.6,7
L’eziopatogenesi della SM
I meccanismi patologici alla base della progressione della SM sono multifattoriali e non completamente noti.8-12
Diversi fattori etiologici, ambientali e genetici sono alla base della malattia; non è chiaro se gli stessi fattori associati ad altri quali ad esempio età, modalità di presentazione della malattia, numero di recidive, carico lesionale alla RM cerebrale e spinale possono convergere nel predire i pazienti che andranno in progressione. Ventinove anni fa, l’IFN sottocute (SC) β-1b è stato autorizzato dalla FDA come primo trattamento prescrivibile per pazienti affetti da SM recidivante remittente. Per il suo meccanismo d’azione si rimanda alla Figura 1.
Figura 1. Meccanismo d’azione dell’IFN-β nella SM.
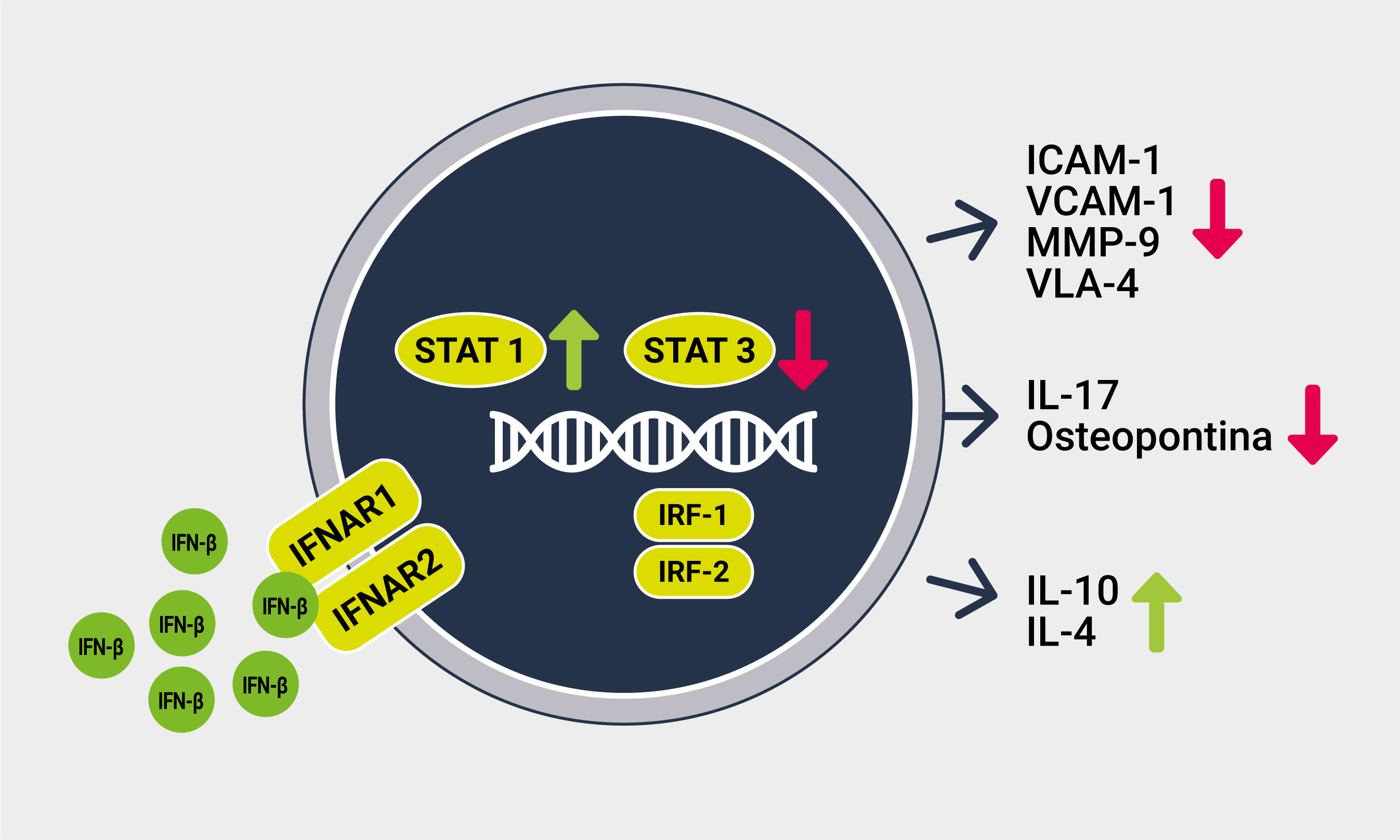
L’interferone beta (IFN-β) si lega al recettore dell’interferone α/β presente sulla superficie cellulare dei linfociti CD4+, esercitando un’attività antiinfiammatoria. IFN-β impedisce la migrazione cellulare a livello della barriera ematocefalica attraverso l’inibizione di MMP-9, riducendo il rapporto MMP-9/TIMP1 e l’espressione delle proteine VCAM e ICAM-1. IFN-β regola la produzione di citochine pro-infiammatorie IL-17 e delle osteopontine attraverso l’attivazione del complesso STAT-1 e l’inibizione di STAT-3, nonché riducendo la secrezione di IL-17 delle cellule T mediante la via di segnale IFNAR delle cellule dendritiche e mieloidi. Dall’altra parte, IFN-β favorisce la produzione di citochine antinfiammatorie Th2 come IL-10 e IL-4. Ulteriori studi, in vitro e su modelli animali, hanno suggerito che IFN-β favorisce la riparazione del CNS e il recupero dal danno neuronale attraverso l’attivazione di NGF negli astrociti. IFN-β presenta un ruolo attivo nella regolazione dell’attività autoimmune attraverso l’incremento delle cellule NK CD56 che producono citochine antinfiammatorie come IL-10 e interagendo con le cellule T autoimmuni a livello dei tessuti linfoidi secondari e nel sistema nervoso centrale.
I vari studi hanno dimostrato che l’IFN β-1b può favorevolmente incidere sul decorso della malattia riducendo il numero di recidive, di nuove lesioni T2 e di lesioni captanti gadolinio.13 Studi successivi hanno confermato che ogni interferone ha effetti simili a quelli precedentemente osservati negli studi registrativi dell’IFN β-1b, anche se alcuni head to head (INCOMIN ed EVIDENCE) hanno dimostrato che l’alta dose dell’IFN β-1b e di altre formulazioni di IFN β-1a può determinare risultati migliori in termini di numero di recidive e parametri di RM di quanto osservato nei pazienti trattati con IFN β-1a per via intramuscolare 1 sola volta a settimana (Tabella 1).14,15
Va inoltre segnalato che per oltre 20 anni, in Europa, l’IFNβ-1b è stato l’unico farmaco registrato, prescrivibile e rimborsabile per il trattamento della sclerosi multipla in fase secondariamente progressiva (Tabella 1).16
I risultati pubblicati nel 1993 sull’IFN β-1b sono stati realizzati grazie ad un progetto sperimentale imperniato su due studi identici condotti dal 1988 al 1990. Il placebo è stato confrontato con due diverse dosi di IFN β-1b (1,6 MIU e 8,0 MIU), entrambe somministrate per via sottocutanea a giorni alterni. Gli endpoint primari di questi studi sono stati rappresentati dalle differenze nei tassi di esacerbazioni e dalla percentuale di pazienti che rimangono liberi da ricadute. Come sopra riportato, lo studio ha mostrato risultati dose-dipendente con significativa riduzione del tasso annuale di esacerbazione nei pazienti trattati con alte dosi di IFN β-1b rispetto al placebo. Inoltre, nello stesso gruppo è stata riscontrata una maggiore percentuale di pazienti liberi da ricadute (36 vs 18, rispettivamente). Il secondo studio, invece, ha esplorato principalmente gli effetti dell’IFN β-1b sulla RM, con risultati favorevoli nel gruppo trattato con IFN β-1 b in termini di carico lesionale già al primo anno. Gli eventi avversi sono stati sempre ben gestiti: dalla sindrome influenzale, all’aumento delle transaminasi e al distiroidismo. Più rare altre manifestazioni di natura trombogena.
L’IFNβ-1b è stato testato anche nella forma secondariamente progressiva. La progressione della disabilità, misurata da un aumento di 1.0 punto all’EDSS sostenuto per almeno 3 mesi è stata individuata quale endpoint primario. Lo studio ha rilevato una differenza statisticamente significativa, a favore del gruppo trattato con IFN β-1b, con ritardo di progressione di 9-12 mesi e una riduzione del 30% del tasso annuale di recidiva. Nello stesso studio è stata osservata nel gruppo di pazienti trattati con IFN β-1b una riduzione del 32,1% della percentuale di pazienti che ha dovuto fare ricorso alla carrozzina. Tra gli eventi avversi, va segnalato il rischio di incremento della spasticità (Tabella 1).16
Tabella 1. Principali studi randomizzati di efficacia dell’IFN β-1b
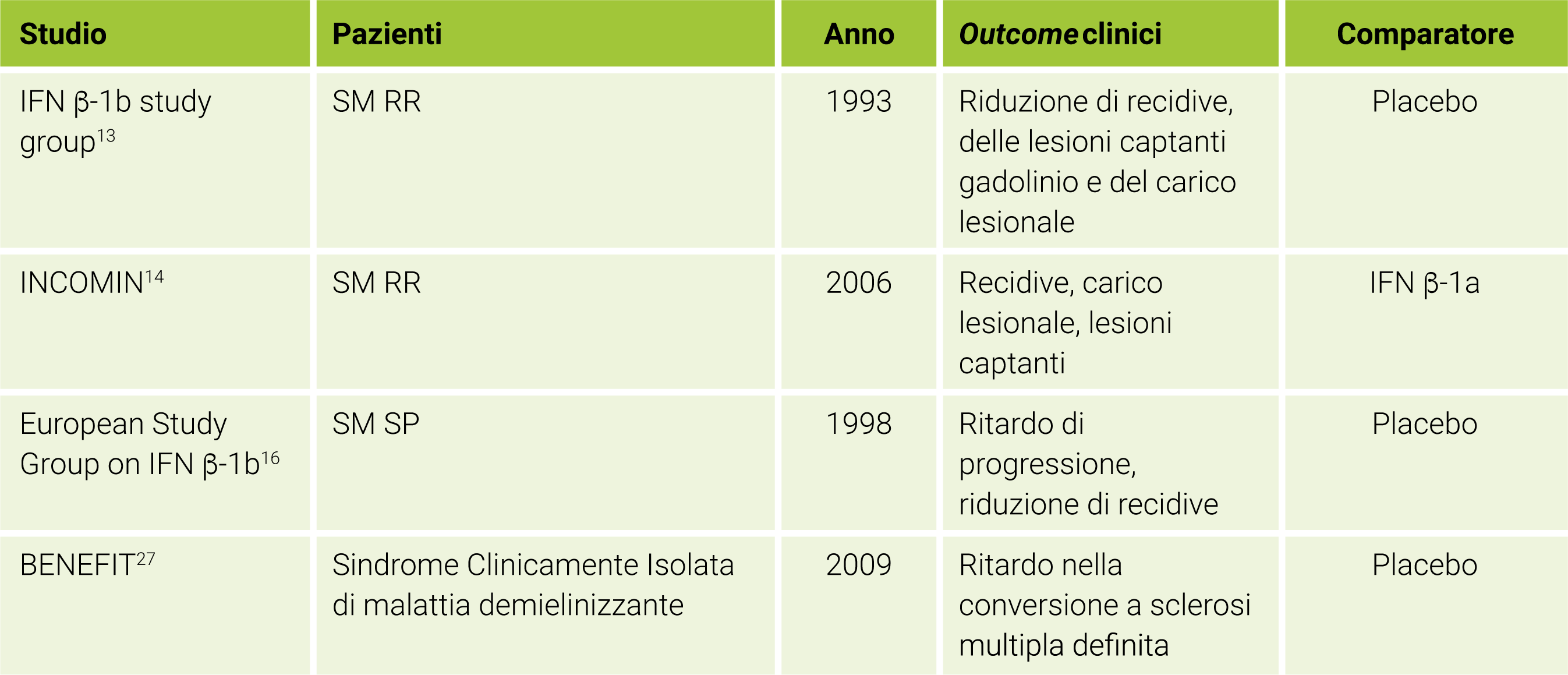
SM: Sclerosi Multipla; RR: Recidivante Remittente; SP: Secondariamente Progressiva
IFN β e qualità della vita
Gli esiti riferiti dai pazienti (Patient Reported Outcomes, PROs) sono diventati sempre più importanti nella ricerca e nella pratica clinica per la comprensione degli effetti della SM sulla quotidianità dei pazienti. I PROs includono fra gli altri aspetti lo stato di salute generale, l’impatto dei sintomi della SM, il funzionamento fisico e mentale e la QoL correlata allo stato di salute (HRQoL). I sintomi neurologici lamentati dai pazienti con SM possono interferire con la vita di tutti i giorni e i diversi farmaci presentano un impatto diverso in questi ambiti specifici che sono indicativi dello stato di malattia del paziente. Certamente gli interferoni e l’IFN β-1b potrebbero esercitare un effetto detrimentale sulla qualità della vita per aspetti di scarsa tollerabilità: eritema sul sito di iniezione, dolore, elevata frequenza di somministrazioni, sindrome simil-influenzale, necrosi cutanea e altri. Tuttavia, studi datati e altri studi più recenti dimostrano che gli interferoni non hanno effetto negativo su qualità della vita,17 considerando gli effetti di questa classe di farmaci sul decorso della malattia. Nel tempo, molti eventi avversi che incidevano negativamente su tollerabilità e qualità della vita sono stati migliorati dall’utilizzo di specifici devices di autoiniezione che hanno ridotto il burden per il paziente e una migliore accettazione della terapia.18,19
IFN β e depressione
L’uso terapeutico degli IFN è stato associato ad un aumento del rischio di sentimenti soggettivi di malattia, tra cui affaticamento e depressione.20
Effetti collaterali neuropsichiatrici, tra cui depressione e idee di suicidio, sono stati identificati per la prima volta in pazienti trattati con IFNα per infezione da epatite virale.
L’ampio uso di interferoni e più segnatamente di IFN β-1b non supporta l’associazione tra terapia con IFN β e la depressione. Una revisione sistematica di 10 studi ha rilevato la mancanza di un’associazione tra depressione e terapia con IFN β. Tre studi su 10, invece, hanno mostrato che i pazienti con pregressa diagnosi di depressione potrebbero sviluppare un episodio depressivo maggiore durante i primi 6 mesi di trattamento.21
Il ruolo di IFN β nel panorama terapeutico della SM - Escalation versus terapia ad alta efficacia
Le terapie modificanti il decorso della malattia (DMTs), variano in termini di efficacia, profilo di sicurezza, modalità e facilità di somministrazione.22 Il beneficio del trattamento precoce nella SM evidenzia l’importanza della scelta della terapia sin dalle prime fasi della malattia.23
Sono molti i fattori che incidono sulla scelta del trattamento; tra questi trovano un ruolo non trascurabile, oltre agli aspetti più precipuamente riconducibili allo stato e al decorso della malattia, età, sesso, potenziale fertile, condizioni di comorbidità precedenti l’uso di DMTs, tollerabilità e costi. L’approccio terapeutico più comunemente considerato è quello di utilizzare una prima linea di terapia modificante il decorso, cui si attribuiscono caratteristiche di maggiore sicurezza e profilo di moderata efficacia (rispetto alle DMT ad alta efficacia), seguito da un periodo di monitoraggio della evoluzione clinica e di escalation verso un trattamento più efficace, se e quando l’attività della malattia lo richiede.24
Tuttavia, rovesciando l’ipotetica piramide temporale, I linea seguita da II linea, con un approccio che vede sin dall’inizio la II linea, ovvero trattando precocemente il paziente con terapie ad alta efficacia, si potrebbe prevenire l’accumulo di danni irreversibili del sistema nervoso centrale, persino nel lungo termine.25 Va sottolineato, però, che le terapie ad alta efficacia possono essere associate a maggiore rischio di eventi avversi.25 Pertanto, la decisione se iniziare il trattamento con farmaci ad alta efficacia o passare alla seconda linea in seguito deve essere opportunamente ed accuratamente valutata in termini di rapporto rischio/beneficio.
Nel corso degli ultimi 2 anni si è assistito alla pandemia SARS-CoV-2; è noto che l’interferone possiede attività antivirali (come precedentemente riportato) e che non altera affatto la risposta anticorpale ai comuni vaccini, inclusa la risposta anticorpale ai vaccini adottati per contrastare il Covid-19. Di contro, gli anti-CD20, il fingolimod e altri farmaci immunosoppressivi (ozanimod, ponesimod, alemtuzumab) alterano la risposta anticorpale sierologica, non facendola montare quasi del tutto e inducono i clinici a ritardare la somministrazione di DMTs. Anche in quest’ottica l’IFN β-1b potrebbe essere una valida alternativa ponte.26
Setting di pazienti che potrebbero trarre maggiore beneficio dal trattamento con IFN β
Sindrome Clinicamente Isolata di malattia demielinizzante
Si è accennato prima all’impiego precoce dei farmaci modificanti il decorso della malattia, in quei pazienti che non soddisfano ancora i criteri della diagnosi di SM e che sono classificati come affetti da Sindrome Clinicamente Isolata di malattia demielinizzante. Tutti gli studi di settore, incluso il BENEFIT che ha studiato questo effetto in pazienti esposti a placebo o IFN β-1b, hanno dimostrato un netto ritardo nella conversione a sclerosi multipla definita in quei pazienti che erano stati randomizzati sin dall’inizio a trattamento con IFN β-1b (Tabella 1).27,28
Gravidanza
Gli IFN (interferoni) sono ben tollerati in gravidanza e in donne che allattano. Altri DMTs, invece, sono controindicati prima/durante la gravidanza (fingolimod o teriflunomide). Pazienti trattati con questi farmaci, potrebbero fruire di un periodo “ponte” che sfrutti l’utilizzo di IFN β e la sospensione dei farmaci controindicati nel periodo periconcezionale e di gestazione.29,30
L’AIFA ha già revocato da un anno la controindicazione di non uso in gravidanza nel Riassunto delle Caratteristiche di Prodotto degli IFN β.
Pazienti ad alto rischio infettivo e popolazione anziana
I pazienti ad alto rischio di infezioni gravi, come i pazienti più anziani e pazienti con comorbidità nei quali potrebbero aumentare i rischi associati ai farmaci ad alta efficacia, possono beneficiare del profilo di sicurezza dell’IFN β.
Dato il ruolo degli IFN nelle risposte immunitarie native a infezioni virali, non sorprende che le proprietà antivirali di IFN β siano state così ampiamente studiate nella SM.31
In risposta al nuovo coronavirus (Covid-19), è stato ipotizzato che gli IFN possono, in combinazione con altri agenti antivirali, risultare efficaci per il trattamento di infezione da coronavirus, anche nelle sue forme più gravi.32
Recentemente è stato osservato che il trattamento combinato con lopinavir, ritonavir, ribavirina e IFN β-1b è risultato più efficace del semplice trattamento con antivirali, senza IFN β-1b.33 In un altro studio osservazionale, l’interferone è risultato il DMT associato a minore frequenza e minore gravità di infezione da SARS-CoV-2.34
L’età della popolazione di pazienti affetti da SM è in aumento a causa del maggiore uso di terapie efficaci per la SM e migliori interventi per le comorbidità associate alla SM.35-37
I pazienti anziani affetti da SM hanno spesso età e comorbidità che possono renderne più complessa la gestione.38,39
Tanto accade, perché l’invecchiamento è spesso accompagnato da immunosenescenza, ovvero una riduzione della funzione dell’immunità innata e adattativa40 che colpisce tanto le cellule B41 quanto le cellule T CD4+ e CD8+.41,42
Il consolidato profilo di sicurezza dell’IFN β suggerisce la sua potenziale utilità nei pazienti più anziani, in particolare quelli con comorbidità, i cui rischi potrebbero essere aumentati da alcune terapie per la SM.
La prescrivibilità e rimborsabilità di IFN β-1b nelle forme secondariamente progressive ne rende più facile l’uso in quei pazienti che sono in una fase di transizione da SM recidivante-remittente alla forma secondariamente progressiva, intervenendo tempestivamente e precocemente con una terapia efficace prima che il passaggio alla forma secondariamente progressiva sia definitivo.
Diversi studi hanno affrontato il ruolo dei farmaci modificanti il decorso della malattia sui disturbi cognitivi; tutti questi studi, inclusi quelli che hanno riguardato l’IFN β-1b hanno dimostrato un impatto favorevole reale, significativo e clinicamente rilevante. In pazienti con Sindrome Clinicamente Isolata di malattia demielinizzante, questo effetto è stato rilevato sin dalle prime battute e si è mantenuto per tutto il tempo di esposizione al trattamento.
Conclusioni
Dalla scoperta del ruolo antivirale degli IFN nel 1957, la ricerca ha dimostrato che l’IFN β è un immunomodulatore43 che promuove la produzione di citochine antinfiammatorie,44,45 ed è implicato in diversi processi della complessa risposta immunitaria.46
Summary



Lascia un commento