Introduzione
Il segno distintivo dell’universo femminile è la perdita periodica di sangue mestruale che, dal menarca alla menopausa, rappresenta un chiaro segnale biologico delle variazioni ormonali ovariche1. Una moltitudine di sintomi e condizioni cliniche nella donna possono avere una espressione catameniale2,3 che è funzionale a garantire gli obbiettivi riproduttivi favorendo le capacità adattative dell’organismo femminile.
La mestruazione è però molto più di un semplice fenomeno biologico che caratterizza l’essere donna. Il suo significato è evoluto nel tempo e attraverso le culture, includendo aspetti psico-sociali. La mestruazione contribuisce, inoltre, al divario di genere (gender gap) a tutt’oggi.1 Infatti, le donne hanno certamente acquisito un maggior grado di consapevolezza e controllo delle specificità connesse alla periodicità mestruale, ma le manifestazioni catameniali possono esercitare un peso significativo sulle attività della vita quotidiana contribuendo allo stigma del genere femminile.4
La salute mestruale e la gestione delle sindromi dolorose correlate al ciclo mestruale sono state ampiamente studiate in letteratura da un punto di vista psiconeuroendocrino5-7, ma vengono non sempre considerate meritevoli di un trattamento dal momento che sono di natura transitoria ed, in fondo, connaturate alla femminilità. In particolare, la sindrome premestruale (PMS) ed il disturbo disforico premestruale (PMDD) sono condizioni mediche comuni che vengono scarsamente riconosciute nella pratica clinica perché la diagnosi si basa sulla presenza di sintomi di natura soggettiva, che possono manifestarsi in modo variabile durante i diversi stadi della vita riproduttiva della donna e non sono supportati da misure oggettive o da esami di laboratorio.8 Tali condizioni richiedono l’utilizzo di adeguati metodi diagnostici di raccolta dei sintomi soggettivi riportati dalle pazienti o di interviste cliniche strutturate e di un approccio terapeutico integrato.8
Definizioni dei disturbi premestruali
La sindrome premestruale è un disordine complesso multiforme molto comune nelle donne in età riproduttiva. Esso comprende almeno un sintomo fisico, emotivo o comportamentale che compare dopo l’ovulazione, nella fase luteale del ciclo mestruale, e si risolve poco dopo l’inizio della mestruazione.9 Alla fase premestruale sono stati attribuiti una varietà di sintomi tra cui i più comuni sono la mastodinia, il gonfiore, la cefalea, gli sbalzi umorali, la depressione, l’ansia, la rabbia e l’irritabilità. Una sindrome premestruale moderato-severa viene diagnosticata quando questi sintomi interferiscono con la vita quotidiana personale e lavorativa durante almeno due cicli mestruali10 (Figura 1). La forma più severa di PMS è definita PMDD (disturbo disforico premestruale), una condizione caratterizzata prevalentemente da sintomi emotivi e affettivi, non correlati ad una patologia psichiatrica sottostante.11 La diagnosi di PMDD richiede la presenza di almeno un sintomo correlato all’umore (deflessione timica, ansia o tensione, marcata labilità affettiva, irritabilità) in presenza di almeno cinque sintomi che si manifestano nella fase luteale di due cicli ovulatori analizzati in modo prospettico (Figura 1). I sintomi devono essere associati ad un forte distress nelle attività sociali, scolastiche e lavorative e non dovrebbero essere l’esacerbazione di una condizione clinica preesistente o il risultato dell’effetto di terapie mediche.12
Figura 1. Eterogeneità dei sintomi di PMS/PMDD.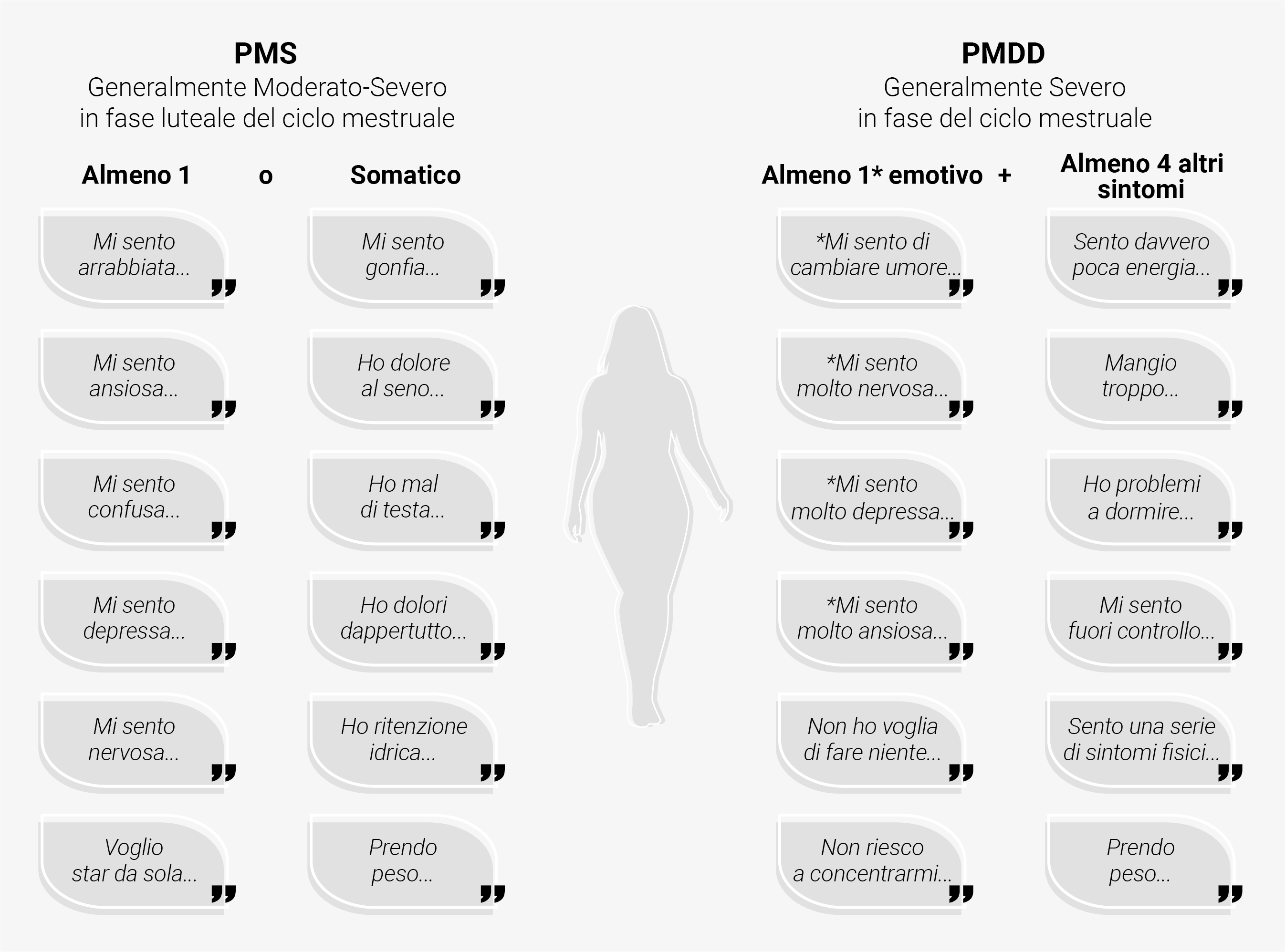
La Società Internazionale dei disordini premestruali (ISPMD) distingue la PMS/PMDD da altre varianti di disordini premestruali. Tra queste vi sono l’esacerbazione premestruale di altre condizioni cliniche (es: asma, allergie, epilessia, emicrania, diabete, sindrome del colon irritabile, malattie autoimmuni) e sintomi correlati all’attività ovarica a parte l’ovulazione o anche in assenza di essa (somministrazione di progesterone esogeno o progestinici, soppressione della mestruazione).13 PMDD è una categoria diagnostica appartenente ai disturbi depressivi nel Manuale Diagnostico e Statistico dei disturbi mentali (DSM-5)14, recentemente codificato anche come diagnosi ginecologica nella Classificazione D-11).15 Il riconoscimento di PMDD come un disordine ginecologico neuro-ormonale e non soltanto come un disordine psichiatrico è di fondamentale importanza, ed è parte di una serie di condizioni note con il termine di “depressione riproduttiva”16, di cui fanno parte i disordini depressivi peri/postnatali e peri/ postmenopausali. Essi, infatti, sono strettamente correlati dal momento che condividono una vulnerabilità neuroendocrina agli eventi riproduttivi, e non dovrebbero essere confusi con altri disordini psichiatrici severi.17 In un contesto di cura multispecialistico, al fine di escludere la coesistenza con disordini bipolari ed altri disordini psichiatrici13,18, PMS/PMDD dovrebbero sempre essere screenati nella storia riproduttiva di una paziente e accuratamente analizzati con parametri psicometrici19 al fine di individuare le donne che potrebbero beneficiare di trattamenti neuroattivi e ormonali.13,17 Attualmente, esistono numerosi strumenti di screening19 che offrono una diagnosi retrospettiva, come ad esempio il Questionario di screening dei sintomi premestruali (PSST)20, ed una valutazione prospettica come il calendario delle esperienze premestruali (COPE).21 Entrambi gli approcci possono essere soggetti ad un margine di errore dovuto alla natura soggettiva dei sintomi che influenza la “reale” epidemiologia della PMS/PMDD.22
Epidemiologia e fattori di rischio della PMS/PMDD
I sintomi premestruali sono molto comuni e colpiscono circa la metà della popolazione mondiale femminile in età riproduttiva.22 Tuttavia, i tassi di prevalenza variano ampiamente nei diversi studi e diverse nazioni a seconda del campione scelto, dei metodi investigativi e dei criteri diagnostici utilizzati. Le differenze possono derivare anche da fattori genetici e socio-culturali, compresi la dieta e lo stile di vita, le attitudini personali, i fattori di stress, i comportamenti sessuali, il carico di lavoro e le responsabilità familiari.22 Indagini disponibili nella popolazione indicano che la PMS colpisce il 20-30% delle donne, mentre la PMDD varia tra l’1.2 e il 6.4%.23 Inoltre, le donne di colore sono significativamente meno colpite dalla PMS e PMDD rispetto alle donne bianche (OR: 0.44, 95% CI: 0.25-0.79 e OR: 0.64, 95% CI: 0.47-0.88, rispettivamente), così come osservato per altri disordini mentali.24 Entrambe le condizioni riducono significativamente la qualità di vita ed aumentano i costi sociali correlati, in termini di diminuzione della produttività lavorativa, assenteismo sul lavoro ed aumento di accesso ai servizi sanitari.25 La prevalenza e l’impatto di PMS/PMDD rappresentano delle forti priorità per implementare strategie preventive nelle giovani donne.26 I professionisti in ambito sanitario dovrebbero essere consapevoli che i sintomi premestruali possono fluttuare nel tempo senza un impatto chiaro a seconda dell’età o dell’epoca riproduttiva, fatta eccezione per la transizione menopausale.27,28 Un altro fattore rilevante è che i contraccettivi orali combinati (COC), la tipologia più studiata di contraccezione ormonale combinata (CHC), può migliorare la sintomatologia premestruale nelle donne con PMS/PMDD, ma non i sintomi depressivi premestruali.29 I fattori di rischio comportamentali, specialmente il fumo e la tendenza all’obesità, sono frequentemente presenti nelle donne con PMS/PMDD, confermando la correlazione di questi ultimi con la vulnerabilità emotiva. Il fumo è stato infatti associato ad un aumentato rischio di disordini premestruali (OR: 1.56; 95% CI: 1.25-1.93) e l’effetto maggiore è stato evidenziato per PMDD (OR: 3.15, 95% CI: 2.20-4.52) rispetto a PMS (OR: 1.27; 95% CI: 1.16-1.39).30 La forte correlazione lineare tra l’indice di massa corporea (BMI) e il rischio di incidenza della PMS è molto evidente, con un aumento di ogni kg/m2 di BMI associato ad un significativo aumento del 3% nel rischio di PMS (95% CI: 1.01-1.05).31 In particolare, le donne con BMI >27,5 kg/m2 hanno un rischio significativamente più alto di avere PMS rispetto alle donne con un BMI <20 kg/m2, stratificando per età, abitudine al fumo, attività fisica ed altri fattori.31 L’utilizzo di alcool è stato associato ad un aumento moderato nel rischio di PMS (OR: 1.45, 95% CI: 1.17-1.79), soprattutto confrontando l’elevato utilizzo di alcool (OR: 1.79, 95% CI: 1.39-2.32) con il non utilizzo o il basso utilizzo.32 Gli studi sull’effetto dell’attività fisica, se pure gravati da molti fattori confondenti metodologici, mostrano alcuni benefici sui sintomi premestruali.33 Altri fatti di rischio conclamati sono gli eventi traumatici, con evidenza di aumentato rischio di sviluppare PMDD nel follow-up (OR: 4.2, 95% CI: 1.2-12.0). In egual modo, un’anamnesi positiva per disturbo d’ansia (OR: 2.5, 95% CI: 1.1- 5.5) ed un alto tasso di conflitti quotidiani (OR: 1.6, 95% CI: 1.1- 2.3) predicono la PMDD.34 La depressione può rappresentare una comorbidità significativa17,18, soprattutto nell’epoca postnatale35, e le donne con PMDD dovrebbero essere considerate ad alto rischio per suicidio, oltre che per un’aumentata vulnerabilità a pensieri, piani e tentativi di suicidio.36 Altre comorbidità sono rappresentate dai disturbi alimentari (soprattutto bulimia e binge eating)37 e dall’emicrania.38 La compresenza di manifestazioni patologiche ad esacerbazione premestruale supporta un’eziologia comune neuroendocrina. 2,3Le condizioni mediche come l’anemia e i disordini endocrinologici (in particolare le disfunzioni tiroidee, surrenaliche e l’iperprolattinemia)13,così come il dolore pelvico cronico, la fibromialgia ed altri disordini infiammatori 39,40, possono mimare i sintomi della PMS/PMDD. I professionisti in ambito sanitario dovrebbero porre una corretta diagnosi differenziale per stabilire e personalizzare la strategia di trattamento.3,8,13
Aspetti neuroendocrini di PMS/PMDD
L’aspetto più caratteristico della PMS/PMDD è la relazione temporale tra la comparsa dei sintomi e la fase mestruale. Essa indica il ruolo degli ormoni steroidei gonadici e dei loro metaboliti nell’influenzare i sistemi biologici che contribuiscono alla regolazione necessaria per il raggiungimento degli obiettivi riproduttivi. Le donne con PMS/ PMDD non mostrano anomalie nel pattern di rilascio degli ormoni riproduttivi; sembrano invece mostrare una soglia neuroendocrina più sensibile alle variazioni cicliche di estradiolo e progesterone41,42 che possono dare origine ai sintomi catameniali e all’esacerbazione dei disturbi comportamentali durante le transizioni riproduttive.43,44 I dati sugli altri ormoni circolanti (prolattina, testosterone, cortisolo, DHEA-S, e tiroxina) sono discordanti e non aiutano a separare le donne con PMS/PMDD dai controlli sani. Essi, però, potrebbero essere rilevanti per alcuni sintomi somatici specifici, come la mastodinia ciclica o la ritenzione idrica.13 Molti fattori genetici ed epigenetici influenzano la soglia neuroendocrina dei sintomi premestruali in accordo con il modello biopsicosociale. La severità dei sintomi comportamentali ed il distress che da essi ne deriva dovrebbero nel loro insieme guidare il giudizio clinico.8,13 La soglia neuroendocrina valutata dai medici può, però, essere diversa da quella percepita dalle pazienti e questo spiega la variabilità epidemiologica dei sintomi di PMS/ PMDD.23 Se la soglia per la diagnosi è troppo alta, sintomi premestruali clinicamente rilevanti possono essere sottostimati e PMS/PMDD rimanere non trattato. Se invece è troppo bassa, le variazioni parafisiologiche nel benessere correlato al ciclo mestruale possono rimanere sottotrattate (Figura 2).
Figura 2. Soglia neuroendocrina e diagnosi di PMS/PMDD.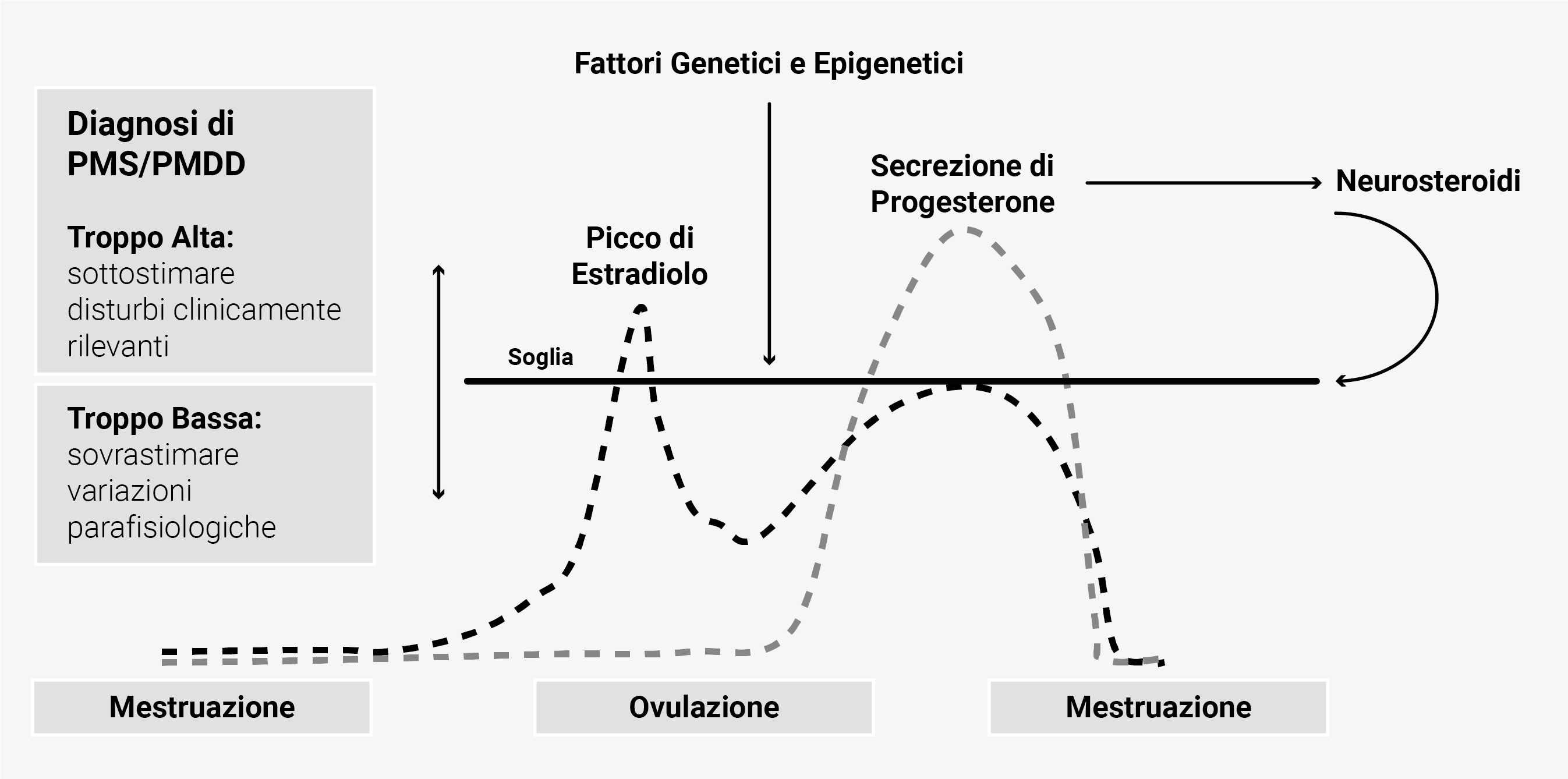
Il Sistema nervoso centrale (SNC) è uno dei principali bersagli degli ormoni riproduttivi, ma è fonte esso stesso di neurosteroidi, metaboliti attivi degli steroidi sessuali, coinvolti mediante meccanismi genomici e non-genomici in un’ampia gamma di funzioni del SNC45-47, la cui descrizione va al di là dello scopo del presente articolo. Qui riportiamo i concetti chiave rilevanti nell’attuale comprensione della patofisiologia e del potenziale trattamento di PMS/PMDD.
Estrogeni e Progesterone
Le transizioni ormonali sono associate ai disordini dell’umore durante la vita riproduttiva, mentre le giovani donne in epoca pre-menarcale e le donne in post-menopausa non risentono della PMS/PMDD, stante l’assenza delle fluttuazioni degli steroidi gonadici. Lo stesso è vero anche quando i livelli degli steroidi gonadici sono alti e piuttosto stabili, come accade in gravidanza.48 Inoltre, i sintomi premestruali non compaiono durante i cicli anovulatori e scompaiono nelle donne in menopausa chirurgica o farmacologica.9 Numerosi meccanismi, che includono i polimorfismi dei recettori degli estrogeni, possono spiegare la vulnerabilità ai disordini dell’umore della vita riproduttiva.49 Fluttuazioni degli steroidi gonadici, in particolare del progesterone prodotto dal corpo luteo, sono i fattori chiave per PMS/PMDD41, dal momento che la sintomatologia è sincrona con la fase post-ovulatoria e la ricorrenza della stessa si verifica in corso di menopausa “chimica” indotta dalla terapia con analogo del GnRH nel momento in cui si somministra il progesterone che torna a mimare la ciclicità ormonale azzerata.50 Molte donne soffrono dei sintomi premestruali immediatamente dopo l’ovulazione e nella fase luteale precoce, mentre altre riportano un’esacerbazione soltanto in alcuni giorni antecedenti la mestruazione, indipendentemente dalle fluttuazioni del progesterone.9 Per questo motivo, è stato indagato il rapporto progesterone/estrogeni, dato che gli estrogeni possono esercitare un effetto antidepressivo e donne con PMS/PMDD e donne sane hanno simili concentrazioni di progesterone circolante.42,52 Un recente studio prospettico ha valutato i livelli di progesterone ed estrogeni nella fase luteale precoce e tardiva in donne con PMDD valutando l’associazione tra questi valori e la severità dei sintomi.53 Nelle donne con PMDD, il livello di estrogeni era inferiore rispetto al gruppo di controllo durante la fase luteale precoce e mostrava una significativa interazione con il progesterone, suggerendo che i bassi livelli di estrogeni possono moderare la severità dei sintomi di PMDD in seguito all’esposizione al progesterone.53 D’altro canto, la somministrazione di estradiolo può provocare disturbi simil-PMS, analogamente alla somministrazione di progesterone da solo o combinato con gli estrogeni.50,54 Inoltre, i sintomi simil-PMS spesso persistono nonostante l’anovulazione indotta dai COC, suggerendo che sia la dose degli estrogeni che il tipo di progestinico possano essere rilevanti per la genesi dei sintomi del tono dell’umore nelle donne suscettibili.55 Infine, donne in post-menopausa che ricevono una terapia ormonale sostitutiva (TOS) possono riportare sintomi simil-PMS, nonostante i livelli stabili di estradiolo e progesterone nel sangue e l’assenza di ovulazione.56 È interessante notare come la somministrazione di mifepristone, un antagonista del recettore del progesterone, non è in grado di ridurre i sintomi fisici, emotivi e/o le manifestazioni comportamentali tipiche della PMS, né di modificarne la periodicità.57,58 Più recentemente, l’ulipristal acetato (UPA), un SPRM di seconda generazione utilizzato come contraccettivo d’emergenza e nella terapia dei fibromi uterini59, è stato testato come possibile opzione terapeutica per migliorare i sintomi delle donne con PMDD. La prima dimostrazione di fattibilità si è osservata in un trial controllato randomizzato con UPA a basso dosaggio (5 mg/ die) che ha mostrato un miglioramento dei sintomi emotivi e comportamentali di PMDD.60 È stato interessante notare, attraverso studi di neuroimaging, come nelle donne con PMDD sussista una specifica sensibilità agli steroidi gonadici, confermata anche a livello cellulare61,62, che appare regolata dall’UPA in risposta a stimoli comportamentali.63 Non è ancora chiaro, però, se UPA dimostra un effetto positivo su PMDD bloccando i segnali mediati dai recettori del progesterone o prevenendo l’ovulazione e dunque mantenendo livelli ormonali più stabili. Al momento, la terapia più comune prescritta per la gestione dei sintomi sia fisici che affettivi della PMS è rappresentata dai COC, con il razionale di inibire l’ovulazione.13 La castrazione farmacologica reversibile con agonisti del GnRH si è mostrata un metodo efficace per il trattamento della PMS/PMDD, sia per i sintomi fisici che psicologici.64 Tuttavia, l’aggiunta di una terapia combinata di estrogeni e progestinico per minimizzare gli effetti negativi dell’esposizione nel tempo a bassi livelli di estrogeni circolanti nelle donne in età fertile, può ripristinare sintomi di PMDD in particolare in donne che sono intolleranti ai progestinici.65
Allopregnanolone e il Sistema GABAergico
Il progesterone gioca un ruolo cruciale nell’ambito del SNC grazie al suo metabolita allopregnanolone. Gli enzimi 5alfa-reduttasi e 3alfa-idrossisteroidodeidrogenasi formano questo steroide neuroattivo, che è un potente modulatore positivo del recettore dell’acido gamma-aminobutirrico (GABA). L’allopregnanolone ha, pertanto, l’abilità di aumentare l’inibizione sinaptica ed extra-sinaptica corticale. L’allopregnanolone si lega ad un sito allosterico del recettore GABA-A ed aumenta la sua sensibilità. Essendo un neurotrasmettitore inibitorio, il GABA è un importante regolatore di stress, ansia, vigilanza e soglia convulsiva.47,66,67 L’allopregnanolone aumenta dopo l’ovulazione ed è secreto a livello circolante sia dal tessuto ovarico che surrenalico. La sua insufficienza costituisce una potenziale spiegazione per i comportamenti e gli stati emotivi premestruali, ma non tutti gli studi hanno mostrato una minore concentrazione dei metaboliti del progesterone nelle donne con PMS rispetto ai controlli, sia in condizioni basali che sotto stimolo.68-71 In aggiunta, la durata dell’esposizione all’allopregnanolone potrebbe giocare un ruolo critico. Nelle pseudogravidanze ottenute nel modello murino, la repentina caduta dei livelli di allopregnanolone esita in una reazione simil-ansiosa.72 Studi sugli effetti sull’umore della terapia orale con progesterone hanno mostrato una relazione bimodale a forma di U invertita tra la severità dei sintomi del tono dell’umore ed i livelli di allopregnanolone. Per esempio, donne in post-menopausa trattate con diversi dosaggi di progesterone orale hanno mostrato il punteggio più elevato di umore negativo quando i livelli di allopregnanolone era uguali ai livelli fisiologici della fase luteale; d’altro canto, il deterioramento emotivo era meno evidente per livelli più bassi o più alti di allopregnanolone.73
Un recente studio randomizzato controllato ha dimostrato che la dutasteride, un inibitore della 5alfa-reduttasi, bloccando la conversione del progesterone in allopregnanolone, riduce significativamente i sintomi (e., irritabilità, ansia, tristezza, craving e gonfiore) in donne con PMDD, senza esercitare alcun effetto nei controlli sani.74 Possibile che l’allopregnanolone a concentrazioni elevate possa causare una sedazione attivando i recettori GABA, ma comportare anche reazioni paradosse con umore alterato in donne suscettibili.75 I COC esercitano effetti neurobiologici, inclusa un’alterazione dell’azione dell’allopregnanolone che è per lo più una caratteristica di una specifica classe di progestinici che mostra alcune proprietà androgeniche.76 In donne sane senza sottostanti disordini dell’umore o stati d’ansia, non si assiste però al cambiamento del tono dell’umore, sia pure in presenza di una riduzione dei livelli circolanti di allopregnanolone.77 È importante ricordare che una pillola a basso dosaggio di etinil-estradiolo contenente il progestinico anti-androgenico drospirenone, che ha anche attività anti-mineralcorticoide oltre a quella antiandrogenica, può aiutare nel trattamento dei sintomi premestruali.78 Questo si verifica nonostante la riduzione degli steroidi ansiolitici, come il pregnanolone.79 L’effetto che i COC hanno sull’umore è molto variabile e dipende non soltanto dalle caratteristiche biochimiche degli steroidi esogeni, ma anche dal tipo e dalla severità dei sintomi. È indubbio che nelle donne con storia di disturbi dell’umore o PMDD si verifichi una scarsa risposta in generale.80,81 Sono stati proposti regimi ormonali che riducono l’intervallo libero degli estrogeni o che sopprimono le mestruazioni come migliori alternative per stabilizzare lo stato ormonale82,83, ma studi più accurati sono necessari per selezionare appropriatamente le donne candidabili nella pratica clinica. Considerando la plasticità dei recettori GABA-A durante il ciclo ovarico (ossia i cambiamenti nella composizione delle subunità e nelle proprietà farmacologiche) nei modelli animali84, risposte anormali dell’allopregnanolone possono essere prevenute bloccando la sua azione sul recettore GABA-A. È certo che l’effetto dell’allopregnanolone può essere antagonizzato dal suo isomero endogeno,
l’iso-allopregnanolone (Sepranolone, UC1010), un antagonista del recettore GABA-A.85 In uno studio randomizzato in doppio cieco che ha utilizzato il sepranolone nel PMDD, la somministrazione sottocutanea di 10 mg ogni 48 ore nei 14 giorni antecedenti la fase mestruale ha ridotto significativamente i sintomi, l’invalidità e il distress personale. Il farmaco è stato ben tollerato e nessun problema di sicurezza è emerso, anche sul versante del ritmo del ciclo mestruale.86
Sistema Oppioide
Dati preliminari indicano una transitoria caduta premestruale delle beta-endorfine plasmatiche nelle pazienti con PMS.87 ed una ridotta soglia, sia nel riflesso RIII (Tr) che nella soglia psicofisica del dolore (Tp), durante la fase luteale, specialmente in donne che riportano punteggi più alti di PMS.88 Una riduzione del tono oppioide centrale nella fase luteale media dimostra una difficoltà di adattamento nelle donne con PMS che mostrano anche alterazioni transitorie dell’asse ipotalamo-ipofisi-surrene.89,90 In aggiunta, la riduzione degli oppioidi inibitori è responsabile dell’aumento della frequenza e della riduzione dell’ampiezza nella pulsazione ritmica dell’LH e della conseguente modalità di rilascio del progesterone nelle pazienti con PMS, supportando la nozione che la PMS è un disturbo neuroendocrino.91
Sistema Serotoninergico
Donne con PMS/PMDD hanno mostrato una disregolazione serotoninergica con trasmissione atipica, minore densità dei recettori di trasporto, ridotti livelli plasmatici di serotonina nella fase luteale e aumentata responsività alla serotonina nella fase follicolare piuttosto che in quella luteale.92 Gli steroidi gonadici modulano significativamente il sistema serotoninergico a più livelli del SNC, influenzando l’umore ed il comportamento.93 Gli estrogeni aumentano la degradazione degli enzimi MAO coinvolti nel catabolismo della serotonina, con conseguente maggiore disponibilità della serotonina stessa nel SNC, mentre il progesterone potenzia l’attività dei MAO che a loro volta riducono la serotonina.94 Inoltre, un dato di estremo interesse consiste nell’aumentata reattività dell’amigdala durante la fase luteale nelle pazienti con PMDD.52 Le vie serotoninergiche hanno una forte influenza su questa area del cervello che processa emozioni come aggressività ed ansia grazie anche alla modulazione degli steroidi gonadici.9 Molto interessante anche il dato dell’interazione tra sistema serotoninergico e sistema GABAergico fortemente modulata dall’attivazione dell’enzima 3alfa-idrossisteroido-deidrogenasi coinvolto nella produzione dell’allopregnanolone.95 Stante il ruolo decisivo della serotonina nella modulazione dell’umore e del comportamento, gli inibitori del re-uptake della serotonina (SSRIs), come per esempio fluoxetina, paroxetina, sertralina, escitalopram e citalopram, sono efficaci nel ridurre i sintomi di PMS/ PMDD, sia se vengono assunti soltanto nella fase lutale, sia se assunti cronicamente. Tuttavia, gli effetti collaterali degli SSRI possono compromettere l’aderenza al trattamento.96 Anche gli inibitori del re-uptake della serotonina e della noradrenalina SNRIs (per esempio, venlafaxina) hanno mostrato efficacia nel trattamento di PMS/PMDD, mentre gli antidepressivi che agiscono principalmente a livello del sistema noradrenergico o dopaminergico non migliorano significativamente i sintomi di PMS/PMDD.97 Al momento, gli SSRI costituiscono la prima linea di trattamento per le forme severe di PMS/PMDD ed il loro uso, da solo o in combinazione con terapia cognitivo-comportamentale, ha raggiunto un buon grado di consenso.8,13
Altri scenari in tema di neuroinfiammazione
Nuovi scenari nella neuroendocrinologia intravedono una correlazione tra i processi infiammatori ed i disordini psichiatrici e somatici, coinvolgendo anche alcuni aspetti della PMS/PMDD.98 L’estradiolo ed il progesterone hanno proprietà antinfiammatorie ed antiossidanti, e la caduta della loro concentrazione nella fase luteale tardiva porta ad un aumento dello stress ossidativo a livello endometriale ed alla sintesi di molecole pro-infiammatorie quali prostaglandine, citochine, chemochine e metalloproteasi della matrice endometriale.99 Specifiche chemochine predicono sintomi di PMS, sottolineando una possibile correlazione tra utero e funzione cerebrale tramite l’asse utero-chemochine-encefalo.100 In aggiunta, alcuni studi hanno mostrato aumentati livelli di fattori pro-infiammatori in donne con PMS101 ed una correlazione positiva tra la proteina C reattiva (PCR) e la severità dei sintomi della PMS, specialmente legati all’umore, al comportamento ed al dolore.102 Servono però un maggior numero di studi per validare il ruolo dell’infiammazione, dello stress ossidativo e dei sistemi antiossidanti nella fisiopatologia della PMS.103 Interessante notare come i livelli circolanti del fattore neurotrofico cerebrale (BDNF), un regolatore della neurogenesi in risposta agli steroidi gonadici, siano ridotti in donne con PMS.104 Altre interessanti prospettive puntano alla neuroinfiammazione correlata al sistema GABAergico come fattore eziologico della PMS/PMDD105, oltre alla potenziale influenza dell’asse
encefalo-intestino nella modulazione della severità dei sintomi premestruali, conseguente ai cambiamenti del microbiota intestinale in dipendenza dal progesterone.106
Iter Diagnostico
Il primo passo nella gestione di PMS/PMDD è stabilire una diagnosi rigorosa, dal momento che non esistono analisi di laboratorio o segni clinici obbiettivi e il sospetto diagnostico si basa su di una sintomatologia auto-riferita che deve essere monitorizzata nel tempo, almeno per due mesi prospetticamente. Recentemente, il gruppo di studio di endocrinologia ginecologica della Società Italiana di Ostetrica e Ginecologia (SIGO) ha riassunto le modalità più opportune per inquadrare i sintomi di PMS/PMDD107 nella pratica quotidiana del ginecologo suggerendo gli elementi anamnestici base (Tabella 1) per cercare di identificare le pazienti a maggior rischio psichiatrico e di proporre un percorso terapeutico individualizzato sulla base della tipologia e della severità dei sintomi.
Tabella 1 Elementi Anamnestici Base per la diagnosi di PMS/PMDD
La diagnosi deve basarsi sui criteri della Figura 1 e può essere formulata mediante l’utilizzo del PSST20, un questionario retrospettivo di screening che comprende 19 elementi che consentono alla paziente di dare un valore alla severità dei sintomi (Tabella 2).
Tabella 2 Questionario di Screening dei sintomi premestruali (PSST).
Ha riscontrato uno o più dei seguenti sintomi con insorgenza prima del ciclo mestruale e remissione entro qualche giorno dall’inizio del ciclo? Si prega di contrassegnare con una X la casella appropriata.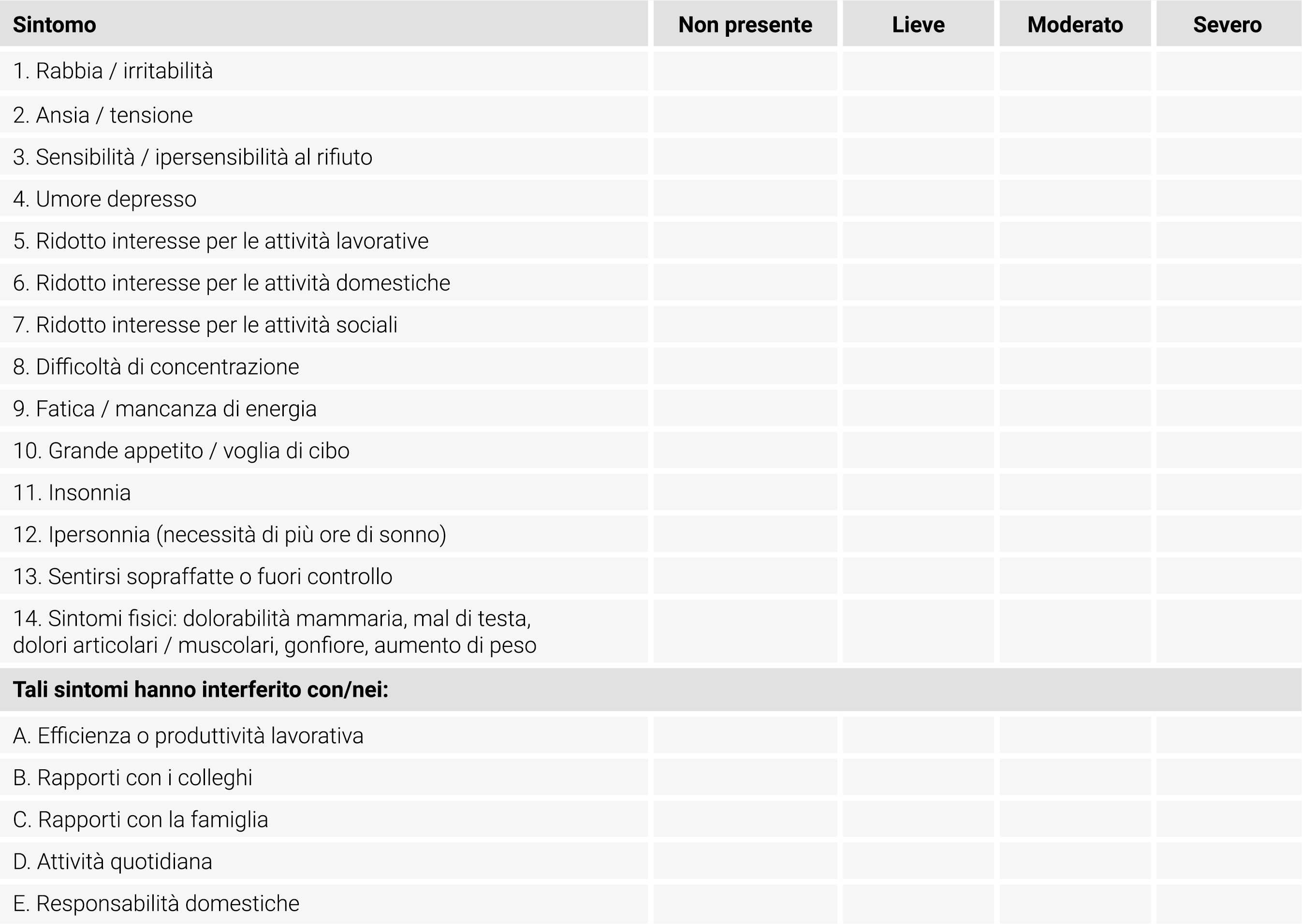
Lo strumento più affidabile per la valutazione dei sintomi in modo prospettico è l’utilizzo di un diario in cui la paziente riporta la propria sintomatologia in termini di modalità di insorgenza, durata e severità dei sintomi in relazione alle diverse fasi del ciclo mestruale, per un periodo che comprenda almeno due cicli mestruali. I questionari diagnostici di uso corrente nella pratica clinica prevedono l’attribuzione di un punteggio ai diversi sintomi e comprendono una serie di diari possibili. Il COPE21 include 22 sintomi raggruppati in 4 categorie: sintomi reattivi dell’umore, sintomi del sistema autonomo/cognitivo, sintomi del sistema appetitivo, sintomi correlati alla ritenzione idrica.
Anche una scala visuo-analogica (VAS) dei principali sintomi riportati dal DSM-5 (sbalzi d’umore, irritabilità, ansia e depressione) che consiste in una linea verticale di 100 mm etichettata 0 = “nessun sintomo” all’estremità sinistra e 100 = “grave” all’estremità destra può essere utile a quantificare l’entità dei disturbi.
Attualmente, nessun diario mestruale è stato universalmente accettato come scala prospettica ideale.
Dopo il completamento del diario mestruale13, le donne possono mostrare:
- sintomi che sono iniziati nella fase premestruale e sono
andati in remissione all’inizio delle mestruazioni o poco
dopo (PMS o PMDD);
- sintomi che peggiorano durante la fase premestruale
(peggioramento premestruale di un’altra condizione);
- sintomi continui o sporadici non correlati a una fase del ciclo mestruale (né PMS, né PMDD).
Spesso, i sintomi caratterizzanti la PMDD (nervosismo,
depressione, ansia e umore labile) sono gli stessi di quelli riscontrati da donne con altri disturbi psichiatrici ed è, dunque, indispensabile escludere un altro disturbo psichiatrico preesistente.13,16,17 Il fattore chiave nel formulare la diagnosi è l’associazione temporale dei sintomi con il ciclo mestruale. Alcune diagnosi differenziali includono:
- Disturbo depressivo maggiore: i sintomi della depressione comprendono umore basso, anedonia, alterazioni dell’appetito, disturbi del sonno, difficoltà di concentrazione e pensieri suicidari. Circa la metà dei casi di PMS/ PMDD può avere una diagnosi coesistente di depressione. Una diagnosi di PMS/PMDD può precedere una diagnosi di depressione o può essere che i due disturbi coesistano. I criteri per la diagnosi di questi disturbi sono diversi, ma non esclusivi.
- Disturbo d’ansia generalizzato: i sintomi dell’ansia comprendono palpitazioni e sentimenti di paura. I fattori scatenanti gli attacchi di ansia possono essere identificati se la paziente dimostra un atteggiamento di evitamento degli stessi. L’ansia cronica o situazionale non varia con il ciclo mestruale. Disturbo d’ansia generalizzato e PMDD possono coesistere. I criteri sono diversi, ma non esclusivi.
Management terapeutico
Sulla base di quanto riassunto dal gruppo di studio di endocrinologia ginecologica della Società Italiana di Ostetrica e Ginecologia (SIGO) le opzioni terapeutiche della PMS/PMDD comprendono: terapie dello stile di vita e terapie non farmacologiche, agenti psicotropi, terapie ormonali e sintomatiche come i diuretici (Tabella 3) fino alla terapia chirurgica (annessiectomia) nei casi più difficili di PMDD in donne che hanno completato il progetto riproduttivo (Figura 3). Sarebbe auspicabile che le pazienti con PMS/PMDD potessero seguire anche terapie di supporto, per esempio terapie psico-comportamentali.13,107,108
Tabella 3 Trattamenti per la gestione terapeutica di PMS/PMDD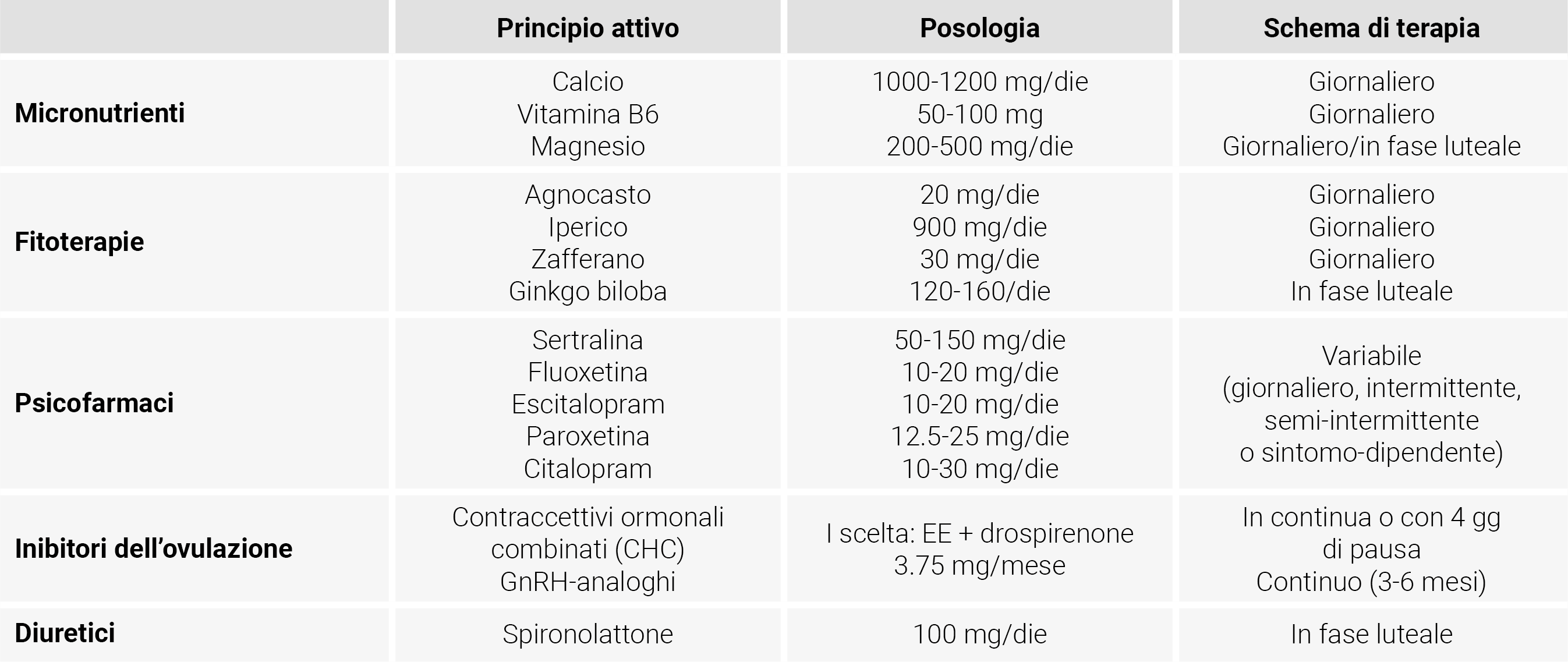
Figura 3 Algoritmo per la gestione terapeutica di PMS/PMDD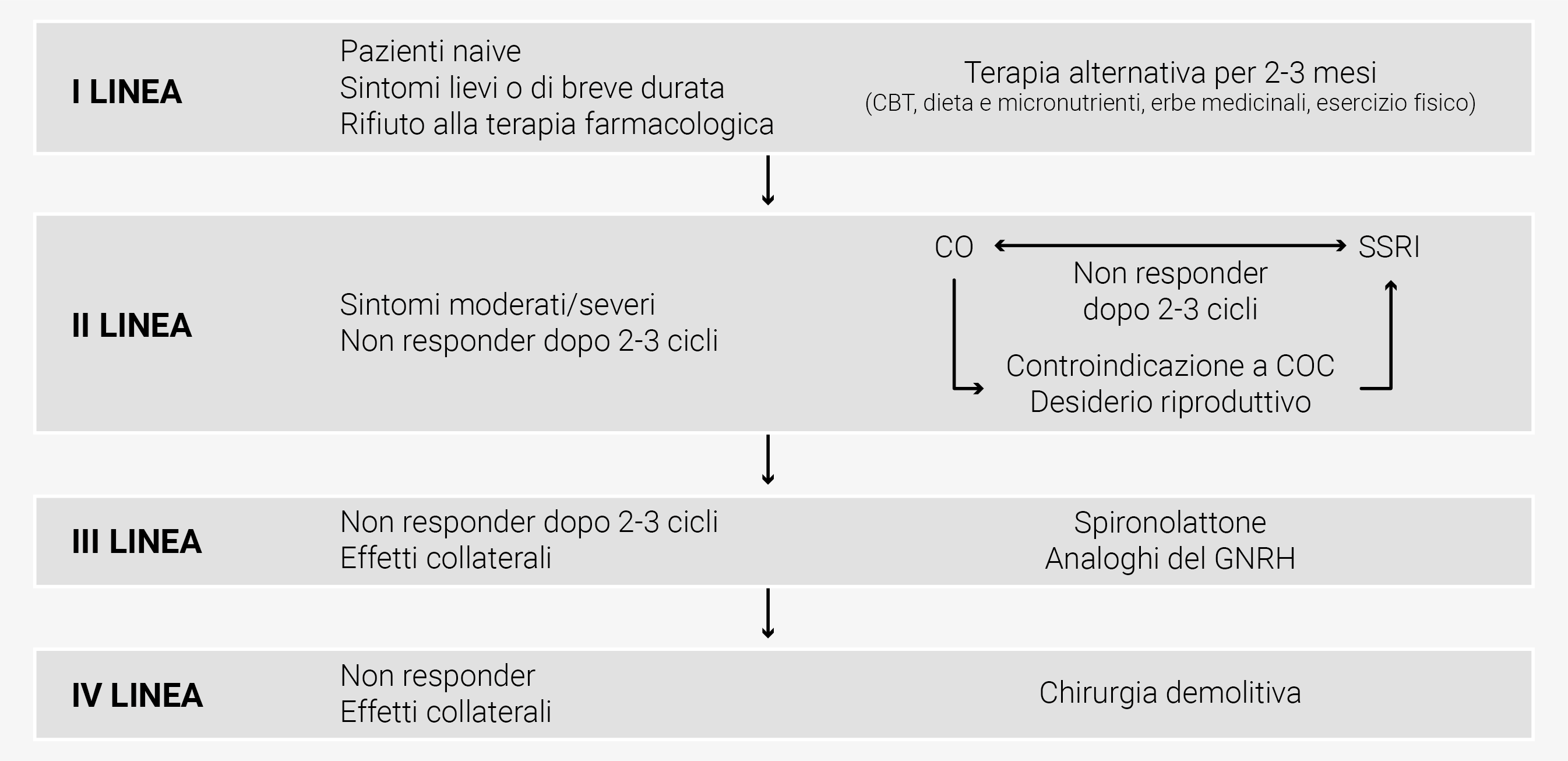
Terapie dello stile di vita e non farmacologiche
- Dieta: durante la fase luteale, la riduzione dell’assunzione di alcool, caffeina e zuccheri semplici a favore dei carboidrati complessi sembrerebbe incrementare il rilascio di serotonina e quindi avere effetti benefici in particolar modo sui sintomi affettivi e comportamentali;
- Esercizio fisico: in qualità di stabilizzatore dell’umore, può determinare un miglioramento dei sintomi sia somatici che affettivi, anche se non vi sono sufficienti evidenze a riguardo;
- Micronutrienti: vitamina B6 (utile al dosaggio di 100 mg/ die; dosi superiori a 200 mg/die possono provocare episodi di neuropatia periferica), calcio (influenza la neuromodulazione e quindi risulta utile nel trattamento di PMS alla dose di 1000-1200 mg/die), magnesio ad elevata biodisponibilità (citrato, pidolato, bisglicinato). Alcuni studi ne evidenziano l’efficacia se somministrato durante la fase premestruale, ossia dal 15° giorno del ciclo mestruale fino all’inizio del flusso successivo, ma può essere assunto anche giornalmente;
- Erbe medicinali: le maggiori evidenze sono disponibili per agnocasto sulla mastodinia e l’adattamento allo stress (alla dose di 20-40 mg/die; agisce legandosi ai recettori D2 della dopamina, a quelli degli oppioidi e ai recettori ß degli estrogeni), ginkgo biloba (utile nel trattamento di diversi disturbi mentali, ha la capacità di migliorare la memoria, grazie alle sue proprietà antiossidanti; è stata dimostrata la sua efficacia se utilizzato durante la fase luteale); iperico (attraverso azione modulatrice sulla sintesi dei neurotrasmettitori; sintomi comuni quali gonfiore, desiderio di cibo, cefalea e faticabilità sono significativamente ridotti con utilizzo di compresse giornaliere da 900 mg); zafferano alla dose di 30 mg/die che agisce modulando l’azione dei neurotrasmettitori e lo stress ossidativo; altre sostanze di medicina complementare e alternativa sono ampiamente utilizzate, ma al momento mancano delle solide evidenze.
- Terapie cognitivo-comportamentali (CBT): sono dei trattamenti psicosociali applicati ai disturbi dell’umore durante i quali la paziente identifica i propri pensieri negativi ed i comportamenti disadattivi. Con una guida professionale, i pazienti sviluppano quindi strategie adattative (coping) per affrontare i modelli di comportamento non sani. Si è rivelata particolarmente utile per affrontare i disagi somatici e affettivi associati alla PMS/PMDD aiutando le donne a gestire i sintomi emotivi.
Si raccomanda un periodo di trattamento di almeno 3 mesi.
Agenti psicotropi
Gli inibitori della ricaptazione della serotonina (SSRIs) rappresentano i farmaci psicotropici di prima scelta, con effetti che coinvolgono l’allopregnanolone ed il sistema GABAergico. Vi sono quattro principali strategie di trattamento con SSRIs:
-
<em>Continua </em>: si è dimostrata più efficace nel ridurre i sintomi depressivi e somatici ed andrebbe consigliata alle pazienti che presentano sintomatologia (anche se subclinica) durante la fase follicolare e alle donne con cicli mestruali irregolari, quindi incapaci di identificare l’inizio della fase luteale. È utile, inoltre, per le pazienti che hanno difficoltà nel ricordare di assumere ciclicamente il medicinale o che mostrano effetti collaterali a seguito dell’inizio e della successiva sospensione di assunzione degli SSRI.<br> - Intermittente : somministrazione soltanto durante la fase luteale (inizio: 14 giorni prima dell’atteso flusso mestruale; fine: al primo giorno di flusso mestruale), utile per le donne con cicli mestruali regolari che vogliono limitare gli effetti collaterali a lungo termine, in particolar modo le potenziali disfunzioni sessuali.
- Semi-intermittente : prevede un’assunzione quotidiana di SSRI a basso dosaggio, con incremento della dose nel
corso della fase luteale.
- Sintomo-correlata : prevede l’inizio del trattamento in concomitanza alla comparsa dei sintomi, fino all’inizio del flusso mestruale; questa strategia consente alle donne di adattare il regime terapeutico in base alle proprie esigenze.
Tutti i principi attivi dei SSRIs possono essere somministrati con diversi dosaggi: indipendentemente dalla modalità di assunzione, è stata dimostrata l’efficacia dei bassi dosaggi, soprattutto in fase iniziale; se la risposta risulta insufficiente dopo il primo ciclo di trattamento, dovrebbe essere incrementato il dosaggio al ciclo successivo oppure andrebbe cambiata la tipologia di farmaco. Gli effetti benefici possono essere attesi già dopo le prime 48 ore di trattamento, con un tasso di risposta variabile tra il 50 e il 90%. Effetti collaterali come nausea, insonnia, cefalea, affaticabilità, diarrea e vertigini sono comuni all’inizio della terapia con SSRIs (incidenza del 15%), ma usualmente si riducono dopo i primi giorni di trattamento. Al contrario, disfunzioni sessuali come calo della libido o orgasmo ritardato possono persistere (incidenza 9-30%), ma generalmente tendono a scomparire rapidamente dopo la sospensione degli SSRIs. Talvolta, dopo la prima settimana di trattamento, può verificarsi un aumento dell’ansia. A causa del rischio di recidiva, la sospensione della somministrazione continua deve essere graduale e può essere preceduta dallo “switch” ad un regime differente (intermittente). La combinazione di SSRIs con altri farmaci (es. associazione di più antidepressivi) non è stata studiata sistematicamente per il trattamento del PMDD. Le donne desiderose di gravidanza dovrebbero ricevere un counselling specifico sui seguenti aspetti: sospensione delle terapie all’inizio della gravidanza dal momento che i sintomi tendono a regredire. In previsione di una gravidanza è preferibile utilizzare SSRIs compatibili (Sertralina, Citalopram), anche se gli effetti degli antidepressivi sulla gravidanza hanno mostrato risultati controversi e la maggior parte è relativamente sicura, se pure emergono delle preoccupazioni significative relative all’evidenza di un elevato rischio di parto pretermine, di difficoltà di adattamento neonatale e di malformazioni cardiache congenite (soprattutto da paroxetina).
Terapie ormonali
Il razionale di utilizzo delle terapie ormonali si basa sul fatto che in queste pazienti vi è un’alterata sensibilità alle fluttuazioni ormonali tipiche dell’età fertile. Estrogeni e progesterone sono steroidi neuroattivi che possono influenzare direttamente o indirettamente le funzioni del SNC. Tali terapie comprendono:
-
<em>Contraccettivi ormonali combinati (CHC) </em>: agiscono attraverso la soppressione dell’ovulazione e delle fluttuazioni ormonali e dimostrano effetti benefici per i sintomi sia affettivi che somatici; di prima scelta sono le associazioni contenenti drospirenone 3mg/EE 20mcg, di seconda scelta quelle contenenti altri progestinici; la riduzione dell’intervallo libero da farmaco (da 7 a 4 giorni o in somministrazione continua/estesa) è fondamentale per l’efficacia terapeutica; - Estrogeni : l’uso di estrogeni in associazione a progesterone non è supportato da evidenze di sufficiente qualità;
- Progestinici : non si sono dimostrati efficaci e pertanto non sono raccomandati;
- Danazolo : alla dose di 200 mg è stato proposto nella fase luteale per contrastare i sintomi mammari, ma nella pratica clinica è scarsamente utilizzato in quanto gravato da effetti collaterali di tipo virilizzanti, e dunque non viene più considerato;
- Agonisti del GnRH (GnRH-A) : costituiscono l’ultima linea di trattamento delle forme più severe, richiedono l’associazione di add-back therapy (terapia ormonale sostitutiva, tibolone) e monitoraggio della massa ossea con densitometria ossea (DEXA) dopo 6 mesi.
Diuretici
Lo spironolattone, un antagonista del recettore dell’aldosterone, al dosaggio di 100 mg/die durante la fase luteale ha dimostrato riduzione dei sintomi sia somatici che affettivi; necessita però di monitoraggio periodico per il rischio correlato di iperkaliemia.
Trattamenti chirurgici
Ovariectomia bilaterale in donne con PMDD molto severa e non più desiderose di prole, finanche alla istero-annessiectomia bilaterale qualora siano presenti anche alterazioni rilevanti della ciclicità mestruale (menometrorragie, dolore pelvico cronico).
Algoritmo per la gestione terapeutica della PMS/PMDD
L’algoritmo per la gestione della PMD/PMDD prevede la corretta integrazione delle informazioni di carattere diagnostico e di tutte le opzioni di trattamento (farmacologiche e non). Mentre i ginecologi sono responsabili della diagnosi clinica iniziale (anamnesi, valutazione prospettica dei sintomi) e delle cure primarie, per le forme severe e resistenti al trattamento è indicato un approccio multidisciplinare che includa nutrizionisti, psicologi e psichiatri, quest’ultimi indispensabili in presenza di DDFL o di varianti di SPM con comorbidità psichiatriche.13,17,107 Bisogna porre particolare attenzione al counselling nelle pazienti nel post-partum e nella transizione perimenopausale dal momento che sussiste un rischio più elevato di sviluppare depressione.16
Le strategie di trattamento variano in relazione alla intensità dei sintomi (lievi, moderati o severi), desiderio riproduttivo, efficacia, comparsa di effetti collaterali ( Figura 3 ).
In caso di pazienti naïve, sintomatologia lieve o di breve durata, o di riluttanza all’assunzione di farmaci, la prima linea di intervento comprende un trial di 2-3 mesi con terapie come esercizio fisico, dieta (assunzione di carboidrati complessi durante la fase luteale tardiva), vitamina B6 (100 mg al giorno), calcio (1000-1200 mg al giorno), erbe medicinali (Vite agnocasto, Iperico, Zafferano, Ginkgo bilo- ba); è, inoltre, consigliata l’associazione di un ciclo di terapia cognitivo-comportamentale (CBT) che viene di solito effettuato in 12 sedute.
In caso di pazienti con sintomi moderati/severi o con persistenza di sintomi dopo 2-3 mesi di terapie di prima linea, la seconda linea di trattamento comprende in relazione al desiderio riproduttivo, alla necessità di contraccezione, ad eventuali rischi di assunzione di molecole ormonali (per esempio TVP):
- terapia contraccettiva ormonale combinata (CHC) preferendo le associazioni con drospirenone ed un intervallo ridotto a 4 giorni o l’assunzione continua/flessibile
- SSRIs con assunzione iniziale del dosaggio più basso del range delle dosi terapeutiche; se la risposta risulta insufficiente dopo il primo ciclo di trattamento, può essere incrementato il dosaggio oppure cambiato il tipo di SSRI o lo schema di somministrazione.
Alle pazienti che iniziano la terapia con SSRIs dovrebbe essere offerto un primo appuntamento per il follow-up dopo 1 settimana di trattamento, al fine di valutare l’aumento dell’ansia; nelle donne che cercano una gravidanza, è indicato un attento counselling ed è meglio prediligere citalopram e sertralina. In pazienti non-responder o con effetti collaterali, i trattamenti successivi comprendono:
- spironolattone, con counseling specifico per l’uso di metodi contraccettivi di barriera e monitoraggio periodico del potassio sierico;
- GnRH-A 3.75 per almeno 3-6 mesi; il trattamento deve essere interrotto qualora si riscontri una riduzione significativa della densità minerale ossea a distanza.
La chirurgia con ovariectomia bilaterale con o senza isterectomia è l’ultima risorsa terapeutica e non dovrebbe essere presa in considerazione, se non si è prima effettuato un ciclo di trattamento con GnRH-A.
Conclusioni
La SPM è un disturbo molto comune tra le donne in età riproduttiva che il ginecologo è spesso chiamato a diagnosticare con una serie di domande mirate e l’uso di strumenti di monitoraggio della periodicità dei sintomi in relazione alla fase del ciclo mestruale. I sintomi sono sia somatici che emotivi e interferiscono con le attività della vita quotidiana. Talvolta, i disturbi della serie emotiva sono di intensità severa e configurano il PMDD che richiede quasi sempre anche un approccio psichiatrico. Le strategie terapeutiche mirano sia alla soppressione dell’asse ipotalamo-ipofisi-ovaio che alla modulazione dei sistemi centrali di neurotrasmissione, oltre che comprendono terapie dietetiche, nutraceutiche e comportamentali.

Lascia un commento