Lo stato epilettico (SE), massima espressione dell’attività elettrica cerebrale incontrollata, è entrato a far parte della classificazione delle crisi epilettiche dell’ILAE del 19701, venendo definito come “una crisi che persiste per un lasso di tempo sufficiente o che si ripete abbastanza frequentemente da determinare una condizione continuativa e duratura”1.
Nel corso degli anni la definizione di SE è stata rimaneggiata e rivista sino a quella più recente di Trinka e collaboratori,1 secondo cui lo SE può essere definito come “la condizione in cui falliscono i meccanismi che determinano la fine di una crisi epilettica o ne vengono attivati altri diversi responsabili di un prolungamento anomalo della durata di una crisi epilettica”.
Questa più recente definizione concettuale indica lo SE come un’emergenza tempo-dipendente ed evidenzia quanto sia importante essere tempestivi nel suo trattamento.
Si individuano, infatti, da una parte, la durata della crisi epilettica ed il time point (t1) oltre la quale questa può essere considerata prolungata “in maniera anomala” e, dall’altra, il tempo (t2) oltre il quale subentra il rischio di danno cerebrale a lungo termine.1
Mentre il t1 ed il t2 sono stati stimati per lo SE convulsivo generalizzato rispettivamente come 5 e 30 minuti sulla base di studi su animali e della ricerca clinica, per le altre forme di SE le informazioni sono insufficienti o del tutto assenti per poter stimare questi due time point.1
Sulla base della semeiologia, lo SE può essere classificato in convulsivo e non convulsivo (NCSE). Intuitivamente nel primo caso è predominante la presenza di segni motori.1
Lo NCSE, d’altro canto, può avere modalità di presentazione clinica altamente variabili, che includono alterazioni cognitive, arresto del linguaggio, contrazioni muscolari involontarie ed impercettibili a carico del distretto faciale, del tronco o degli arti, deviazione del capo e dello sguardo, segni autonomici (midriasi unilaterale, alterazioni del ritmo cardiaco), automatismi e comportamenti bizzarri.2
In merito alla epidemiologia dello NCSE, gli studi sulla sua incidenza e prevalenza sono di piccole dimensioni e monocentrici, spesso senza una chiara distinzione tra lo NCSE che occorre in Terapia Intensiva e quello che si presenta nella popolazione generale.2
Negli Stati Uniti, l’incidenza stimata dello SE è 15–20/100,000 casi all’anno, di cui sino al 63% è rappresentato dallo NCSE.3
I principali fattori di rischio per lo NCSE sono distinguibili: 2
- nelle persone con epilessia. Presenza di una sindrome epilettica, variazioni della terapia anticrisi, interazioni farmacologiche che abbassano i livelli plasmatici dei farmaci anticrisi;
- nelle persone non affette da epilessia. Disturbi elettrolitici,patologie croniche sia neurologiche sia e non neurologiche (per esempio, tumori cerebrali a lenta crescita, microangiopatia cerebrale diffusa, patologie autoimmunitarie, sindromi paraneoplastiche, patologie metaboliche ereditarie, patologie neurodegenerative) e farmaci/sostanze voluttuarie;
- nei pazienti ricoverati in Terapia Intensiva. Disturbi elettro-litici, alterazioni ormonali acute, stroke ischemico acuto, emorragia intracranica, encefalopatia post-anossica, trauma cranico cerebrale.
Ricorrere all’elettroencefalogramma (EEG) è fondamentale nella diagnosi dello NCSE, poiché la sua presentazione clinica è spesso subdola o aspecifica.4
In occasione del quarto simposio sullo SE tenutosi nel 2013 a Salisburgo, un gruppo di esperti ha proposto dei criteri EEGgrafici per la diagnosi dello NCSE, noti come “Salzburg Consensus Criteria for Non-Convulsive Status Epilepticus (SCNC)”.4
I criteri sono i seguenti:4
- Pazienti senza nota encefalopatia epilettica (Figura 1):
- Presenza di scariche epilettiche ripetitive focali o generalizzate a > 2.5 Hz oppure
- Presenza di scariche epilettiche ≤ 2.5 Hz o attività theta-delta ritmica (> 0.5 Hz) e uno dei seguenti punti:
a) Miglioramento elettro-clinico dopo somministrazione endovenosa di farmaci anticrisi;
b) Presenza di minime manifestazioni cliniche ictali
associate alle precedentemente descritte anomalie
EEG grafiche;
c) Tipica evoluzione spazio-temporale.
- Pazienti con nota encefalopatia epilettica:
- Incremento in intensità e frequenze delle anomalie suddette rispetto all’EEG di base associato a cambi obiettivabili dello stato clinico;
- Miglioramento elettro-clinico dopo somministrazione endovenosa di farmaci anticrisi.
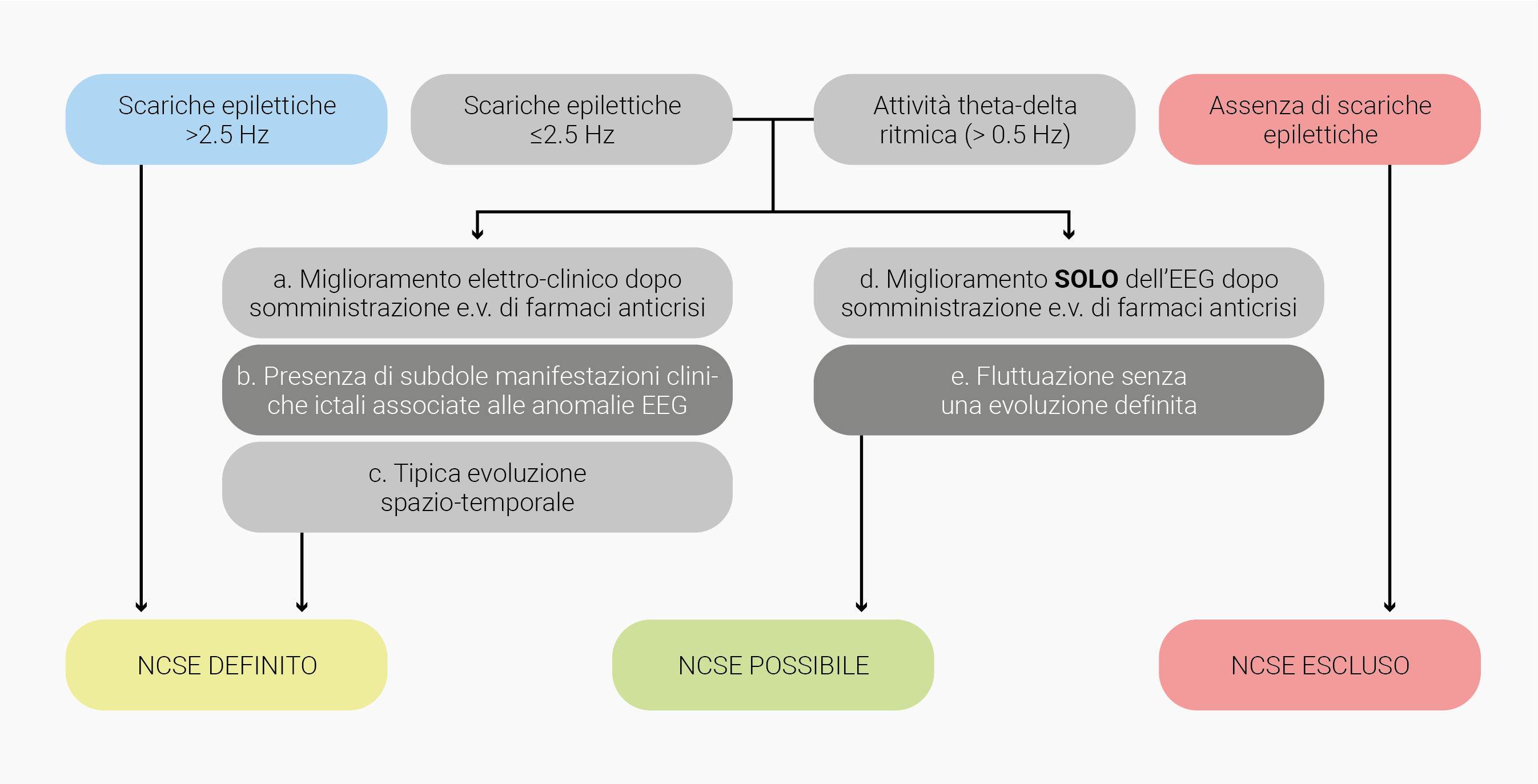 Figura 1 Criteri di Salisburgo per la diagnosi di NCSE nei pazienti senza encefalopatia epilettica nota. (adattato da Othman AS et al. The EEG diagnosis of NCSE: Concordance between clinical practice and Salzburg Criteria for NCSE. Seizure. 2020).
Figura 1 Criteri di Salisburgo per la diagnosi di NCSE nei pazienti senza encefalopatia epilettica nota. (adattato da Othman AS et al. The EEG diagnosis of NCSE: Concordance between clinical practice and Salzburg Criteria for NCSE. Seizure. 2020).
Per “scariche epilettiche” si intendono punte, polipunte, onde puntute, complessi punta-onda lenta.
Per “tipica evoluzione spazio-temporale” si intende o un esordio caratterizzato da aumento del voltaggio e cambio della frequenza o una evoluzione in pattern (cambio della frequenza >1 Hz oppure cambio di localizzazione) o un decremento in voltaggio e frequenza.
Nel caso in cui si assista ad un miglioramento dell’EEG senza miglioramento clinico o ad una fluttuazione senza una evoluzione definita si parla di NCSE possibile.
Tali criteri utili possono essere un valido supporto a livello diagnostico nella pratica clinica.
Tuttavia, ulteriori studi su altre popolazioni, che hanno considerato applicazione, sensibilità e specificità di questi criteri, hanno sottolineato come siano presenti ancora degli elementi da migliorare per affermare una diagnosi certa di NCSE.
Leitinger e collaboratori hanno, infatti, condotto uno studio retrospettivo multicentrico per confermare la accuratezza diagnostica di tali criteri.5 Sono stati presi in esami gli EEG di 120 pazienti con sospetto clinico di NCSE e 100 pazienti con EEG anomalo, ma senza sospetto clinico di NCSE (gruppo controllo). Dopo aver applicato i criteri di Salisburgo, è emerso che il 36% (n=43) dei 120 pazienti del primo gruppo presentavano NCSE con una sensibilità del 97.7% ed una specificità dell’89.6%.5
Solo tre persone nel gruppo controllo rispondevano ai criteri di Salisburgo e sono stati considerati falsi positivi.5
Con una accuratezza del 92.5% registrata nel primo gruppo, i criteri di Salisburgo si sono rivelati di grande utilità nella diagnosi dello NCSE.5
Hanno fatto seguito studi di validazione esterna dei suddetti criteri, come quello di Goselink e collaboratori del 2019,6 che ha utilizzato gli stessi metodi di arruolamento dello studio precedente (soggetti dicotomizzati in pazienti con e pazienti senza sospetto clinico di NCSE) su un totale di 191 registrazione EEGgrafiche. Di questi 191 EEG, il 12% (n=12) è stato classificato come NCSE e, nel gruppo di pazienti con sospetto clinico di NCSE, la percentuale di sensibilità era del 67%, mentre la specificità dell’89%. Nel gruppo controllo (n=93), 10 pazienti erano falsi positivi, con una specificità dell’89.2%.6
Da questo lavoro è dunque emersa una accuratezza inferiore dei criteri di Salisburgo rispetto allo studio originale,5 suggerendo che i criteri da soli non possono sostituire la valutazione attenta nella pratica clinica corrente sia delle informazioni cliniche che di quelle neurofisiopatologiche (EEG) su base individuale e che, in alcune condizioni, le caratteristiche cliniche ed elettroencefalografiche non consentono la diagnosi di NCSE definito bensì di NCSE possibile.6
Uno studio italiano ha dimostrato l’accuratezza dei SCNC nel diagnosticare lo NCSE definito e nell’escluderlo.7
Le differenze rispetto agli altri studi di validità esterna condotti in precedenza sono:7
- mentre negli altri studi lo standard di riferimento era il giudizio di un esperto basato sull’analisi retrospettiva delle informazioni elettro-cliniche, in questo studio lo standard di riferimento era la diagnosi fatta al momento dal neurologo che aveva preso in carico il paziente;
- lo standard di riferimento poteva anche essere un neurologo generale e non un epilettologo specializzato;
- i SCNC sono stati applicati su EEG della durata di circa 30 minuti e non su registrazioni EEG prolungate.
Un recente lavoro del 20228 ha valutato in maniera retrospettiva se i SCNC avessero valore prognostico in pazienti adulti con NCSE di prima diagnosi.8
La coorte danese studiata includeva pazienti con prima diagnosi di NCSE ricevuta tra il 2014 ed il 2017 sulla base dell’EEG eseguito in acuto nel sospetto di NCSE. I pazienti sono stati suddivisi sulla base della frequenza delle anomalie EEGgrafiche in gruppo “fast” (scariche epilettiche > 2.5 Hz) e gruppo “slow” (scariche epilettiche ≤ 2.5 Hz o presenza di attività delta ritmica in aggiunta ad almeno uno dei tre criteri addizionali; vedasi Figura 1). I criteri di Salisburgo sono stati applicati solo dopo una rivalutazione retrospettiva degli EEG da parte di esperti che non erano a conoscenza dell’outcome clinico dei pazienti. Dei 2189 pazienti inizialmente identificati, 133 rispettavano i criteri di inclusione per sospetto NCSE e, di questi 133, 106 rispettavano i SCNC.8
Dopo 2 anni di follow-up, circa 2/3 dei pazienti (65.1%; n=69) era deceduto con la probabilità di sopravvivenza che era minore durante il primo anno successivo allo SE e diventava stabile tra i 2 e 3 anni successivi all’evento.8
Il tasso di mortalità era del 22.6% in ospedale, del 37.7% a 3 mesi dalla dimissione e del 61.3% a 2 anni dalla dimissione. Il gruppo “fast” era associato in maniera significativa ad un migliore tasso di sopravvivenza a 2 anni (mortalità a 2 anni del 50.9% nel gruppo “fast” versus mortalità a 2 anni del 65.3% nel gruppo “slow”), potendo dunque essere le scariche epilettiche rapide un maker prognostico favorevole. L’interpretazione degli autori è che le scariche epilettiche lente (con minore frequenza) in pazienti con NCSE diagnosticato sulla base dell’EEG possano riflettere un danno cerebrale strutturale piuttosto che una disfunzione elettrica cerebrale. Tuttavia, gli autori suggeriscono maggiore approfondimento sui marker EEG come fattori prognostici nei pazienti con NCSE.


Lascia un commento