1. Introduzione
Lo scompenso cardiaco (SC) è una sindrome caratterizzata da sintomi (ad esempio, dispnea, gonfiore delle caviglie, faticabilità) e segni clinici (ad esempio, aumento della pressione venosa giugulare, rantoli polmonari, edema degli arti inferiori) specifici e secondari alla presenza di alterazioni strutturali e/o funzionali cardiache che comportano un aumento delle pressioni intracavitarie e un ridotto output cardiaco a riposo o durante lo sforzo fisico. Durante il percorso diagnostico-terapeutico risulta fondamentale identificarne la causa scatenante che, nella maggior parte dei casi, è legata ad una disfunzione sistolica e/o diastolica ma che può anche essere associata ad una patologia delle valvole cardiache, del pericardio, dell’endocardio o ad anomalie del ritmo cardiaco.1 Da un punto di vista funzionale, lo SC viene classificato in base alla frazione di eiezione del ventricolo sinistro (FE) (Tabella 1). La gravità dello SC può essere classificata con differenti metodi. In clinica la classificazione più usata è quella della New York Heart Association (NYHA) che tiene conto della sintomatologia del paziente - Tabella 1. Da un punto di vista temporale, invece, lo SC viene definito cronico, nei pazienti con una situazione clinica stabile e di lunga durata o con una insorgenza graduale dei sintomi, o acuto quando quest’ultima è più rapida.1
Lo scopo principale di questo documento è quello di fornire una serie di indicazioni di pratica clinica condivise da parte di un Panel di Esperti, in grado di indirizzare i clinici nella gestione terapeutica dei β-bloccanti nei pazienti con SC cronico. Le numerose evidenze scientifiche presenti in letteratura, prevalentemente derivanti da studi randomizzati controllati, hanno dimostrato come l’utilizzo di questa classe farmacologica riduca il tasso degli eventi clinici del paziente con SC in modo proporzionale con la dose raggiunta.2, 3
Tabella 1. Classificazioni dell'insufficienza cardiaca
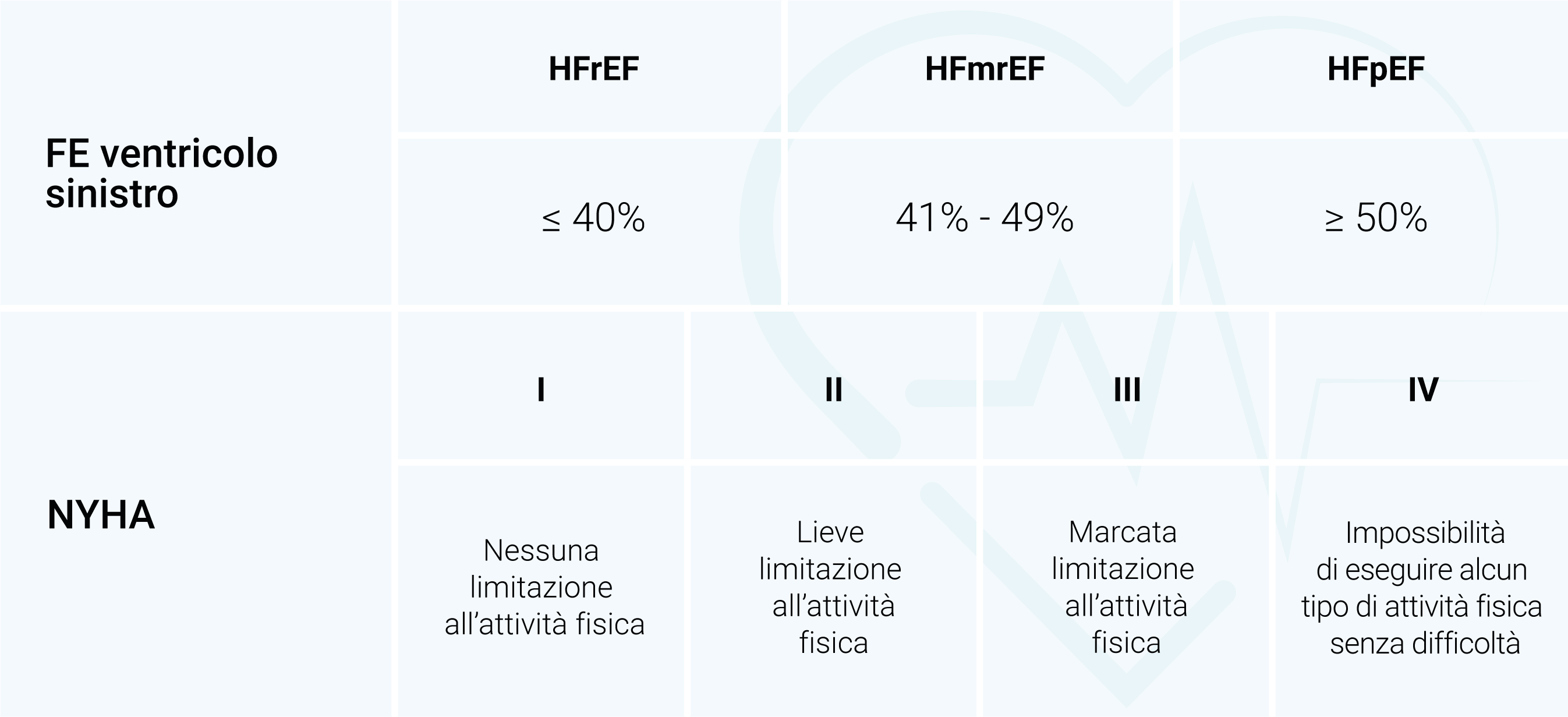
FE, frazione di eiezione; HFmrEF, insufficienza cardiaca a frazione di eiezione moderatamente ridotta; HFpEF; insufficienza cardiaca a frazione di eiezione conservata; HFrEF, insufficienza cardiaca a frazione di eiezione ridotta; NYHA, New York Heart Association
2. Metodologia
Per valutare il livello di consenso tra gli Esperti sulla gestione dello scompenso cardiaco con i β-bloccanti in termini di appropriatezza terapeutica nei diversi setting di pratica clinica è stato utilizzato il metodo Delphi modificato.4
A garanzia della bontà delle indicazioni espresse, sono stati costituiti 2 Board di Esperti in ambito SC: un Comitato Editoriale (CE) e un Comitato Scientifico (CS).
I componenti del CE (5 membri), nonché autori del presente manoscritto, hanno redatto, sulla base delle evidenze scientifiche disponibili, una serie di statement che sono stati successivamente valutati dal CS (9 membri). Quest’ultimo, laddove riteneva opportuno, ha avanzato proposte di integrazione/modifica. Sono stati effettuati due round di votazione da parte del CS, in modalità anonima. Anche le eventuali proposte di modifica/integrazione relative ad uno statement specifico sono state oggetto di votazione da parte del CS sempre in modalità anonima.
Per l’approvazione di ciascuno statement è stato scelto a priori un livello di consenso ≥75% tra i membri del CS. Gli statement così definiti sono stati oggetto di approvazione finale da parte del CE.
La collaborazione tra il CS e il CE così come l’aderenza al metodo Delphi è stata garantita dal Metodologo designato.
3. Risultati
Sulla base dei dati presenti in letteratura e della propria esperienza clinica, il CE ha redatto un panel iniziale di 20 statement che sono stati oggetto di votazione da parte del CS. Di questi, 15 statement (75%) sono stati approvati al primo round con una percentuale di consenso > 75%. I restanti 5, invece, non hanno raggiunto la soglia di approvazione durante il primo round e hanno subito modifiche nel contenuto a seguito di proposte di integrazione raccolte in anonimato tra i membri del CS. Gli statement modificati sono stati sottoposti ad un second round e tutti hanno raggiunto la soglia di consenso prevista.
Inoltre, durante il primo round, il CS ha avanzato la proposta di aggiungere un ulteriore statement che ha ottenuto una percentuale di consenso >75% a seguito di votazione avvenuta durante il secondo round.
Quindi, nel complesso sono stati approvati 21 statement (Tabella 2).
Tabella 2. Risultati riepilogativi in seguito ai due round del metodo Delphi modificato

*I dati disponibili si riferiscono al metoprololo succinato. In Italia è disponibile solo il metoprololo tartrato.
3.1 Aspetti generali
Statement
- I β-bloccanti rappresentano un pilastro irrinunciabile nel trattamento dello scompenso cardiaco congestizio a funzione sistolica ridotta.
- Nei pazienti con scompenso cardiaco a frazione di eiezione ridotta -HFrEF- (≤ 40%), i β-bloccanti hanno dimostrato di ridurre mortalità e ospedalizzazione, migliorare la funzione ventricolare sinistra e la qualità di vita.
- Il beneficio in termini di mortalità della terapia con β-bloccanti nei pazienti anziani può essere ridotto da concomitanti comorbidità e severità delle stesse.
- Nei pazienti con scompenso cardiaco, in assenza di eventi acuti recenti, a frazione di eiezione ridotta con classe NYHA II o III, tutti i β-bloccanti in indicazione prevengono la morte improvvisa. In urgenza o durante tempesta aritmica, il metoprololo* ha mostrato un significativo beneficio.
- Nei pazienti con scompenso cardiaco cronico a frazione di eiezione ridotta, la terapia con β-bloccanti può non aumentare la tolleranza massimale allo sforzo, ma migliora significativamente la qualità della vita.
- I pazienti con scompenso cardiaco e frazione di eiezione “mildly reduced” (ossia frazione di eiezione tra 41- 49%) hanno indicazione alla terapia con β-bloccanti.
- Nei pazienti con scompenso cardiaco cronico a frazione di eiezione conservata, l’indicazione alla terapia con β-bloccanti dipende dalle caratteristiche cliniche del paziente (controllo di frequenza cardiaca, aritmie, ipertensione arteriosa sistemica, concomitanza di eventi ischemici miocardici).
*I dati disponibili si riferiscono al metoprololo succinato. In Italia è disponibile solo il metoprololo tartrato.
Sono diversi gli studi randomizzati controllati che hanno dimostrato l’efficacia dei β-bloccanti, in associazione alle altre classi farmacologiche indicate (ad esempio, ACE-inibitori/sartani ed antialdosteronici), nel ridurre la mortalità e la morbilità nel paziente con HFrEF. In particolare, la riduzione del rischio assoluto di mortalità è stata rispettivamente del 5.5% con il bisoprololo, del 4.6% con il carvedilolo, del 4.5% con il metoprololo*, e del 2.2% con il nebivololo.5-9 La minore riduzione della mortalità riscontrata nei pazienti trattati con nebivololo potrebbe essere associata all’età avanzata dei pazienti inclusi nello studio specifico, con un possibile impatto delle comorbilità presenti sugli obiettivi dello studio ed all’arruolamento di circa 1/3 dei pazienti con frazione di eiezione del ventricolo sinistro > 35%.9 Come riportato da una meta-analisi di 30 studi, l’utilizzo dei β-bloccanti è anche associato ad una significativa riduzione della morte cardiaca improvvisa nel paziente con SC a funzione sistolica ridotta (riduzione combinata del rischio del 31%).10
*I dati disponibili si riferiscono al metoprololo succinato. In Italia è disponibile solo il metoprololo tartrato.
In generale, gli effetti dei β-bloccanti nei pazienti con SC sembrerebbero essere maggiori nei pazienti in ritmo sinusale rispetto a quelli con fibrillazione atriale (Figura 1A e 1B).11 L’efficacia sulla mortalità per ogni causa è stata confermata anche per i pazienti con FE lievemente ridotta (41-49%), ma non per quelli con una FE conservata (Figura 1A).11
Figura 1. Obiettivi clinici (β-bloccanti vs placebo) stratificati per frazione di eiezione del ventricolo sinistro
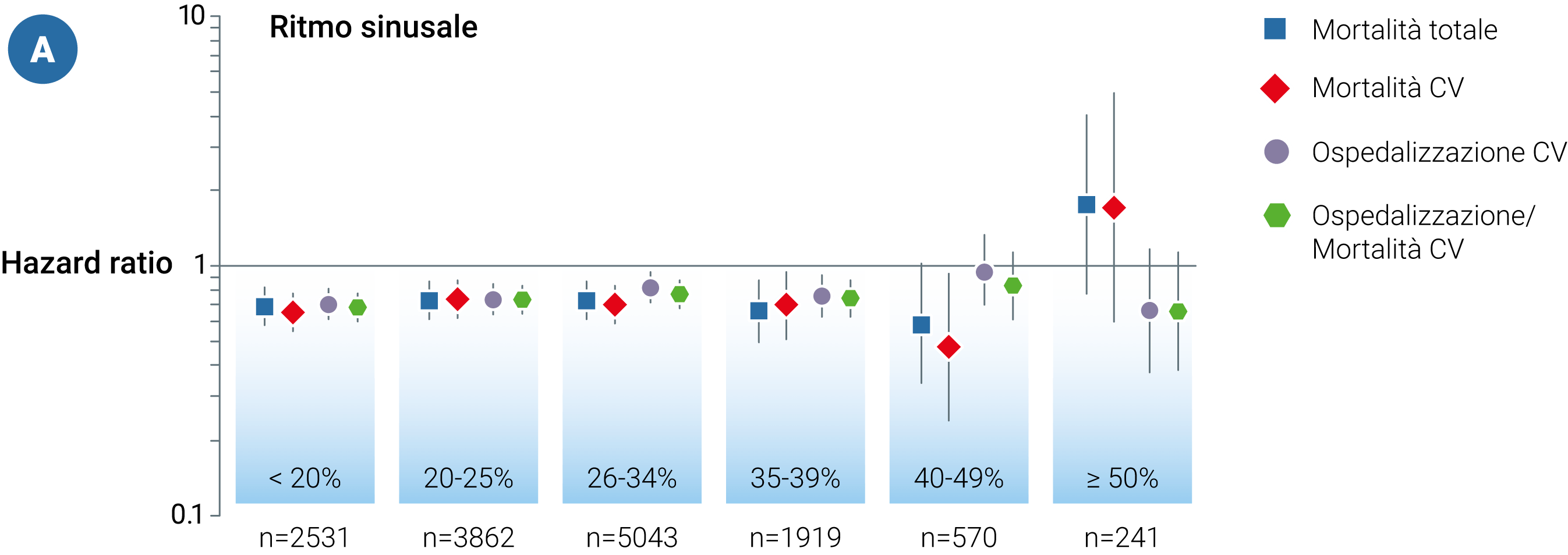
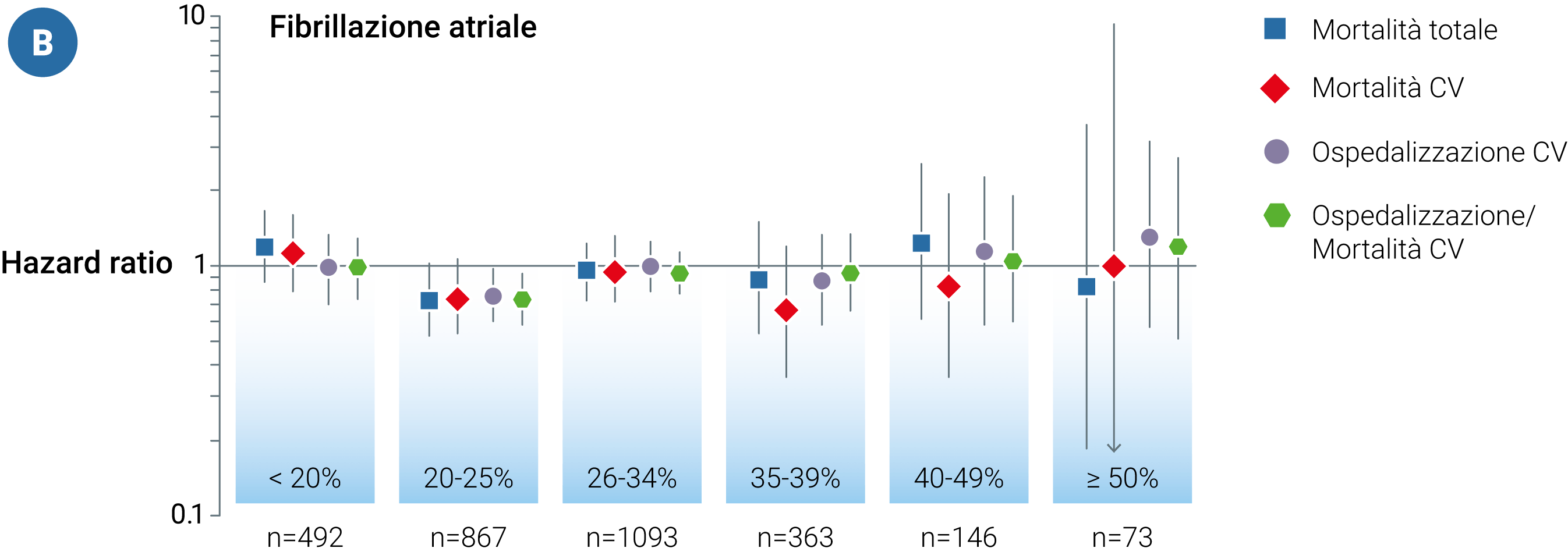
CV, cardiovascolare
Adattata da Cleland JGF, Bunting KV, Flather MD, Altman DG, Holmes J, Coats AJS, et al. Beta-blockers for heart failure with reduced, mid-range, and preserved ejection fraction: an individual patient-level analysis of double-blind randomized trials. Eur Heart J. 2018;39(1):26-35.
Bisogna però specificare che, in quest’ultimo caso, una percentuale rilevante di pazienti potrebbe essere efficacemente trattata con β-bloccanti per la presenza di comorbidità (ad esempio, pregressi eventi ischemici miocardici, fibrillazione atriale ad elevata frequenza cardiaca, ipertensione arteriosa sistemica).2 L’utilizzo dei β-bloccanti, infatti, è associato ad una riduzione della mortalità e delle aritmie maligne nei pazienti con recente infarto acuto del miocardio, così come una riduzione della frequenza cardiaca è stata associata ad un minor rischio di mortalità per causa cardiovascolare e per tutte le cause.12-17 L’effetto benefico dell’utilizzo del β-bloccante in termini di riduzione del rischio di mortalità cardiovascolare e per ogni causa è stato evidenziato anche in particolari categorie di pazienti con ipertensione arteriosa sistemica e stenosi aortica asintomatica).18 Gli effetti benefici dell’utilizzo di tale classe farmacologica nei pazienti con SC non si limitano alla riduzione della mortalità. Nell’HFrEF, i β-bloccanti sono in grado di migliorare la FE del ventricolo sinistro (dal + 4.0% al + 4.9%) con una efficacia similare nei pazienti in ritmo sinusale e in quelli con fibrillazione atriale (Figura 2).11,19
Figura 2. Cambiamento della frazione di eiezione del ventricolo sinistro stratificata per valori basali nei pazienti in ritmo sinusale e con fibrillazione atriale
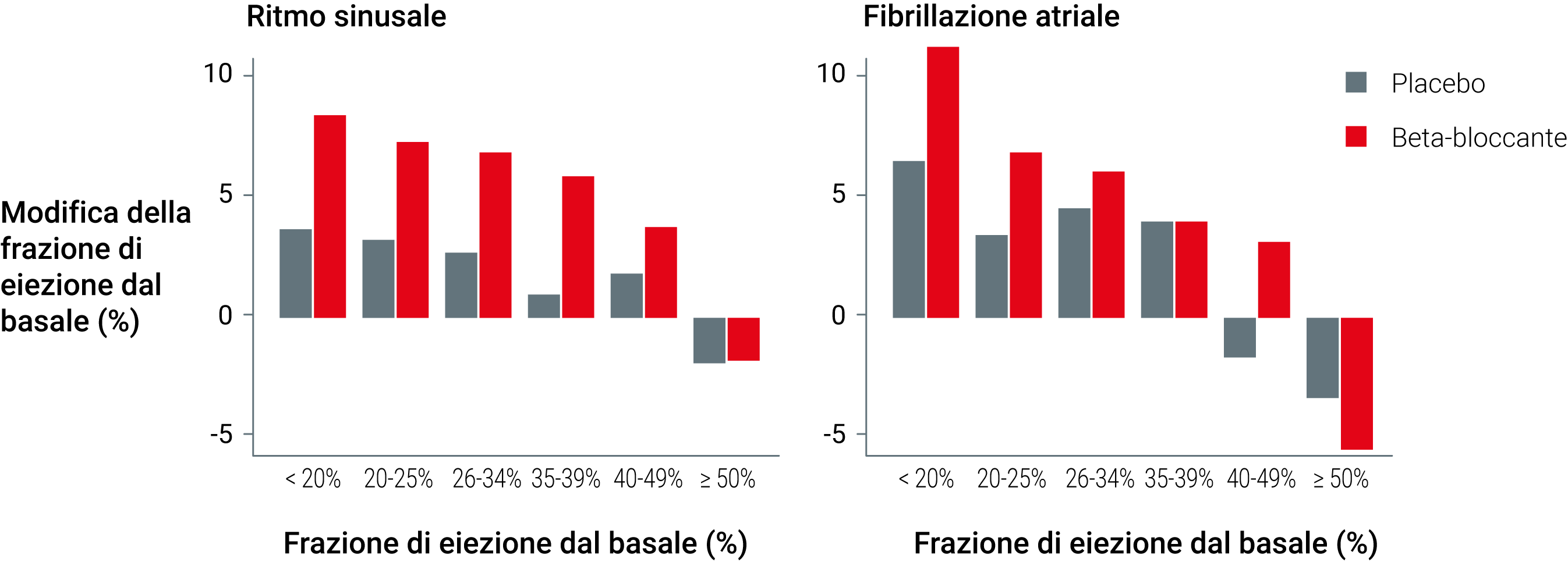
CV, cardiovascolare
Adattata da Cleland JGF, Bunting KV, Flather MD, Altman DG, Holmes J, Coats AJS, et al. Beta-blockers for heart failure with reduced, mid-range, and preserved ejection fraction: an individual patient-level analysis of double-blind randomized trials. Eur Heart J. 2018;39(1):26-35
Questi risultati sono stati confermati da un piccolo studio randomizzato controllato (bisoprololo vs placebo) in cui la FE dei pazienti trattati, valutata tramite risonanza magnetica, è aumentata dal 25% al 36% a differenza della stabilità della FE dei pazienti che hanno ricevuto placebo.23 Infine, l’utilizzo dei β-bloccanti sembrerebbe essere associato anche ad un miglioramento della qualità di vita nei pazienti con SC.20,21 Seppur il principale fattore benefico sembrerebbe essere una modifica positiva del punteggio della scala della depressione rispetto al basale, anche un miglioramento della classe NYHA rispetto al basale sembrerebbe influenzare positivamente la qualità di vita dei pazienti con SC che hanno ricevuto bisoprololo.20
3.2 Titolazione dei β-bloccanti e target terapeutici
Statement
8. La titolazione del dosaggio della terapia con β-bloccanti (bisoprololo, carvedilolo, nebivololo, metoprololo*) che hanno indicazione nello scompenso cardiaco, si effettua tenendo conto di FC target, pressione arteriosa sistemica e tollerabilità.
9. Il raggiungimento di una frequenza cardiaca < 70 bpm (e > 50 bpm), può essere considerato l’obiettivo target della terapia con β-bloccanti nel paziente in ritmo sinusale.
10. Nei pazienti con frazione di eiezione ridotta o “mildly reduced” e fibrillazione atriale, non è mandatorio raggiungere il target di frequenza cardiaca < 70 bpm, fermo restando l’importanza della terapia con β-bloccanti.
11. I β-bloccanti non sono tutti ugualmente tollerati nei pazienti anziani, per cui è necessario personalizzare l’intervento terapeutico in termini di tollerabilità e titolazione del farmaco.
12. Dal punto di vista clinico, in categorie particolari di pazienti (anziani, broncopneumopatia cronica ostruttiva, BPCO), per la maneggevolezza del dosaggio, la possibilità di monosomministrazione, la selettività per i recettori β1, il ridotto impatto sui valori pressori, il bisoprololo presenta una buona tollerabilità.
*I dati disponibili si riferiscono al metoprololo succinato. In Italia è disponibile solo il metoprololo tartrato.
La terapia con i β-bloccanti dovrebbe essere iniziata, nei pazienti emodinamicamente stabili, ad un basso dosaggio e gradualmente aumentata fino al raggiungimento del massimo dosaggio tollerato, idealmente corrispondente al dosaggio target definito dagli studi randomizzati e controllati.2, 22-25 Anche l’utilizzo di basse dosi iniziali del farmaco ha, comunque, dimostrato un effetto benefico sul tasso di mortalità e di ospedalizzazione a 30 giorni dalla randomizzazione.26 Nella Tabella 3 sono riportate le strategie di titolazione dei β-bloccanti attualmente indicati nei pazienti con SC. Ad esempio, il bisoprololo dovrebbe essere iniziato ad un dosaggio di 1.25 mg al giorno e successivamente incrementato di 1.25 mg ogni settimana fino al raggiungimento del dosaggio target (10 mg) o del massimo dosaggio tollerato dal paziente.
Tabella 3. Titolazione dei β-bloccanti indicati nell’insufficienza cardiaca
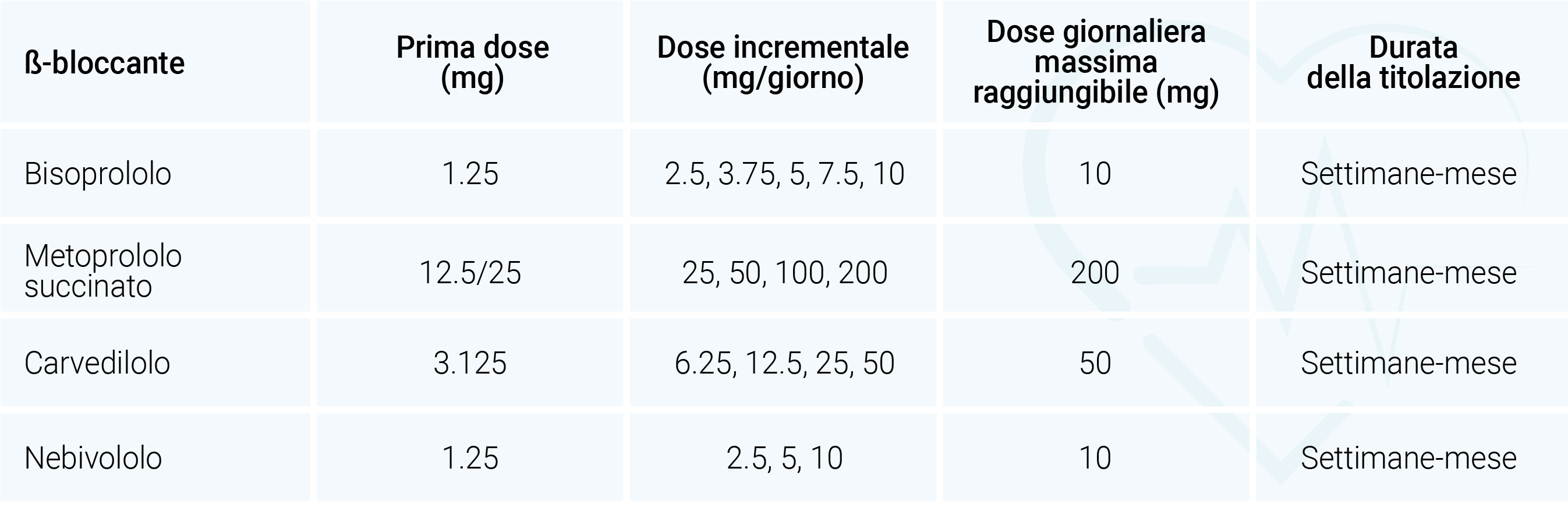
La frequenza giornaliera della somministrazione come negli studi randomizzati di riferimento. Per ulteriori commenti vedi testo.
Adattata da Swedberg K, Cleland J, Dargie H, Drexler H, Follath F, Komajda M, et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J. 2005;26(11):1115-40
La titolazione del farmaco dovrebbe tener conto della risposta individuale in quanto la presenza di comorbidità potrebbe influenzare negativamente l’aderenza farmacologica, la tollerabilità del paziente e l’efficacia del trattamento.23 È d’altro canto evidente che in pazienti con scompenso stabile, a discrezione del clinico, la titolazione dei β-bloccanti può essere semplificata (inizio con dosaggio più elevato con meno step di incremento) e velocizzata.
Risulta, al contrario, necessaria una valutazione clinica ed un monitoraggio particolarmente attento per la possibile associazione tra l’utilizzo e titolazione del β-bloccante e una riduzione eccessiva della frequenza cardiaca, una temporanea depressione miocardica e una esacerbazione dei sintomi dello SC, in particolare nei pazienti più avanzati e nelle fasi di instabilità clinica.2, 22, 23 Infine, anche l’età del paziente deve essere tenuta in considerazione in quanto si è dimostrata essere un fattore significativamente associato al mancato raggiungimento del target terapeutico necessario.23,27 Il raggiungimento della dose target terapeutica, infatti, si è verificato in una minor percentuale di pazienti anziani (31%) che giovani (tra il 42 e l’87%).23
La frequenza cardiaca rappresenta il principale fattore da monitorare durante la terapia con β-bloccante anche se, durante la valutazione clinica, devono essere tenuti in considerazione i valori di pressione arteriosa e la tollerabilità clinica del farmaco (ad esempio, la comparsa di sintomi o di altri effetti collaterali).28-30 In particolare, i risultati di una meta-analisi hanno dimostrato come la riduzione della frequenza cardiaca, e non il dosaggio totale di β-bloccante somministrato, sia correlata in maniera direttamente proporzionale alla riduzione della mortalità.14 Sebbene non siano presenti degli studi randomizzati controllati che abbiano confrontato l’efficacia del raggiungimento di diversi target di frequenza cardiaca, nei pazienti in ritmo sinusale è stato scelto come “effetto target” il limite di 70 battiti per minuto sulla base delle evidenze ad oggi disponibili.28, 29, 31 Infatti, l’efficacia sulla mortalità sembrerebbe essere stata maggiore negli studi in cui la frequenza cardiaca raggiunta al termine della titolazione del β-bloccante era compresa tra 60 e 70 battiti per minuto rispetto a quelli con una frequenza cardiaca raggiunta > 70 battiti per minuto.31 Anche per i pazienti con fibrillazione atriale il target di frequenza cardiaca ottimale non è ben chiaro. Dai risultati degli studi randomizzati a disposizione, sembrerebbe che non ci sia una differenza significativa in termini di mortalità e di rischio di ospedalizzazione o di eventi cardiovascolari tra l’utilizzo di una strategia terapeutica più aggressiva (frequenza cardiaca a riposo < 80 battiti per minuto) e l’utilizzo di una strategia terapeutica meno aggressiva (frequenza cardiaca a riposo < 110 battiti per minuto).32
Rispetto ai pazienti in ritmo sinusale, comunque, nei pazienti
con fibrillazione atriale dovrebbe essere utilizzato un valore target di frequenza cardiaca più elevato, soprattutto nelle fasi iniziali della titolazione del β-bloccante.
Anche la scelta del β-bloccante dovrebbe tenere conto delle caratteristiche individuali del paziente in modo da individuare la molecola che possa garantire il maggior tasso di aderenza e di efficacia alla terapia (ad esempio la maneggevolezza del dosaggio, la mono-somministrazione giornaliera, la cardio-selettività.33
3.3 L’utilizzo dei β-bloccanti nello scompenso cardiaco acuto
Statement
13. I β-bloccanti devono essere tra i primi farmaci ad essere inseriti nella terapia del paziente con scompenso cardiaco congestizio a frazione di eiezione ridotta, tranne nel caso di pazienti con scompenso cardiaco acuto di bassa portata, che generalmente necessitano di inotropi.
14. I pazienti che hanno presentato episodi acuti di bassa portata o che hanno necessitato di inotropi hanno comunque indicazione ad avviare la titolazione graduale del β-bloccante a paziente stabilizzato.
Nei pazienti ricoverati per SC acuto, i β-bloccanti dovrebbero essere iniziati con cautela durante il ricovero, una volta raggiunta la stabilità emodinamica.2,22 La ripresa precoce della terapia medica orale dopo un episodio di SC acuto, prima della dimissione, sembrerebbe, infatti, essere associata ad una aumentata sopravvivenza.26, 34 Sebbene i risultati di un’analisi post-hoc di due studi randomizzati (SURVIVE e ESCAPE) abbiano dimostrato come la prosecuzione del β-bloccante durante la fase acuta dello SC sia associata ad un minor rischio di mortalità per ogni causa a 1 e 3 mesi dalla dimissione, tali risultati devono essere interpretati con estrema cautela in quanto gli studi erano stati progettati per valutare un obiettivo differente e, di conseguenza, le caratteristiche dei pazienti inclusi nell’analisi non erano bilanciati tra i due gruppi di trattamento.35, 36 Con analoghe limitazioni, due ampi registri hanno riportato risultati similari.37,38 I dati, invece, dell’unico studio randomizzato controllato che ha confrontato la prosecuzione con l’interruzione del β-bloccante durante la fase acuta dello SC non hanno riportato nessuna differenza in termini di riduzione della mortalità o del tasso di ospedalizzazione a tre mesi tra i due bracci di trattamento.39 Inoltre, l’utilizzo di inotropi o la presenza di instabilità emodinamica erano criteri di esclusione in alcuni degli studi randomizzati controllati atti a valutare l’efficacia e sicurezza della terapia con β-bloccanti nello SC acuto.5,6
3.4 Scompenso cardiaco e aritmie ventricolari e atriali
Statement
15. I β-bloccanti hanno dimostrato di prevenire in modo significativo le aritmie ventricolari nello scompenso cardiaco modulando e riducendo il tono simpatico.
16. Nei pazienti con scompenso cardiaco a frazione di eiezione ridotta -HFrEF- (FE <40%), i β-bloccanti hanno dimostrato riduzione della mortalità almeno in parte legata al controllo delle aritmie ventricolari potenzialmente letali.
17. Nei pazienti con scompenso cardiaco congestizio cronico e fibrillazione atriale permanente, in trattamento con β-bloccanti si può considerare l’associazione con amiodarone (o in alternativa, digitale in casi selezionati), nel caso di mancato controllo della frequenza cardiaca. Nei casi refrattari alla terapia massimale, considerare ablate-and-pace.
L’attività simpatica gioca un ruolo fondamentale nella modulazione del ritmo cardiaco. In particolare, l’attività β-adrenergica secondaria a stimoli stressanti fisiologici e patologici influenza l’elettrofisiologia cardiaca e può contribuire allo sviluppo di alterazioni del ritmo cardiaco e di aritmie potenzialmente fatali.40 Inoltre, il rimodellamento del ventricolo sinistro che si associa allo SC fornisce un substrato di anomalie strutturali (ad esempio ipertrofia, ischemia, dilatazione, fibrosi) che aumentano il rischio di aritmie. L’incidenza di fibrillazione atriale, infatti, così come quello delle aritmie ventricolari e della morte cardiaca improvvisa, aumentano con il peggioramento della disfunzione ventricolare sinistra.41 Nei pazienti con fibrillazione atriale e SC è stato dimostrato come l’efficacia dei β-bloccanti sia dose-dipendente.42
Diversi studi hanno dimostrato come la terapia con β-bloccanti possa controbilanciare gli effetti pro-aritmici diretti ed indiretti di una aumentata attività adrenergica.40 A seconda del tipo di aritmia, i β-bloccanti riducono il rischio pro-aritmico prevenendo l’innesco di stimoli adrenergici e riducendo la velocità di trasmissione a livello dei nodi seno-atriale e atrio-ventricolare.40,43 L’efficacia anti-aritmica del β-bloccante è stata dimostrata anche negli eventi acuti. I risultati di un recente studio randomizzato, infatti, hanno dimostrato come il metoprololo, rispetto al placebo, sia in grado di ridurre il rischio di aritmie ventricolari maligne in modo significativo (3.6% vs 6.9%) nella fase acuta dopo uno STEMI.44 In maniera similare, l’utilizzo di bisoprololo su modelli porcini di infarto miocardico acuto è stato in grado di ridurre il rischio di aritmie ventricolari.45 Anche il carvedilolo ha dimostrato di ridurre in modo rilevante il rischio di shock da defibrillatore cardiaco impiantabile nei pazienti con SC.46
La gestione di alcuni pazienti (ad esempio quelli con fibrillazione atriale) può richiedere l’aggiunta di alcuni farmaci ai β-bloccanti per il controllo della frequenza o la prevenzione di ulteriori aritmie. Tra questi, l’amiodarone è un agente antiaritmico con delle proprietà complesse tra cui un effetto anti-adrenergico con una plausibile interazione con i β-bloccanti.47 Nonostante ciò, i risultati di una meta-analisi di due studi randomizzati controllati (EMIAT e CAMIAT) hanno dimostrato come l’associazione di amiodarone e β-bloccanti sia associata ad una riduzione della mortalità per cause aritmiche.51 Anche la digitale sembrerebbe essere associata ad una riduzione della mortalità o dell’ospedalizzazione per un peggioramento dello SC e, pertanto, il suo utilizzo potrebbe essere considerato in aggiunta ai β-bloccanti in casi selezionati.48 È tuttavia da considerare che lo studio è stato condotto in un epoca in cui l’utilizzo dei β-bloccanti nello SC non aveva le evidenze oggi disponibili.48 Infine, in alcuni casi selezionati di SC e fibrillazione atriale persistente nonostante la terapia massimale (inclusi i β-bloccanti), può essere considerato l’utilizzo dell’ablazione trans-catetere in quanto associato ad un minor tasso di recidiva di fibrillazione atriale, ad una migliore qualità di vita e della capacità di esercizio fisico e ad una riduzione di ospedalizzazione e mortalità rispetto all’amiodarone.49 In caso di storm aritmici i β-bloccanti non selettivi (propranololo-nadololo) si sono dimostrati più efficaci rispetto ai selettivi.50
3.5 Scompenso cardiaco e BPCO o asma bronchiale
Statement
18. I β-bloccanti β1-selettivi, come il bisoprololo o il metoprololo* o nebivololo, possono essere utilizzati nei pazienti con BPCO e scompenso cardiaco congestizio.
19. I β-bloccanti β1 selettivi ed in particolare il bisoprololo e il nebivololo possono essere utilizzati nella BPCO e nei pazienti con asma lieve-moderata sotto attento controllo specialistico.
*I dati disponibili si riferiscono al metoprololo succinato. In Italia è disponibile solo il metoprololo tartrato.
Circa un terzo dei pazienti con SC hanno una concomitante BPCO rendendone più difficoltosa la gestione terapeutica.55 Le evidenze ad oggi disponibili circa l’uso dei β-bloccanti nei pazienti con SC e BPCO sono limitate. Inoltre, la presenza di malattia polmonare rappresentava uno dei criteri di esclusione della maggior parte degli studi randomizzati controllati designati per valutare l’efficacia e la sicurezza dei β-bloccanti nei pazienti con SC.51 I risultati di una recente meta-analisi hanno invece mostrato come l’utilizzo dei β-bloccanti cardio-selettivi non sembrerebbe essere associato ad un peggioramento della sintomatologica o della funzionalità respiratoria rispetto al placebo, così come non sembrerebbe influenzare la risposta al trat- tamento con β2-agonisti.52-55 Inoltre, l’utilizzo dei β-bloccanti nei pazienti con BPCO sembrerebbe essere associato ad una riduzione della mortalità del 28% e del rischio di riacutizzazione della BPCO del 37%.53,56 Il meccanismo patogenetico con cui i β-bloccanti possano ridurre tale rischio non è ancora ben definito anche se si potrebbe ipotizzare che una percentuale di episodi identificati come riacutizzazioni di BPCO potrebbero essere in realtà eventi cardiaci per cui l’utilizzo del β-bloccante potrebbe essere benefico.57 Il possibile beneficio dei β-bloccanti, ed in particolare del bisoprololo, sulla mortalità nei pazienti con SC e BPCO è stato confermato da un recente studio retrospettivo che ha incluso più di 11000 pazienti.58 I risultati sono stati similari anche in altri studi.59, 60 Il sistema β-adrenergico, infatti, è costituito da recettori β1 e β2 che sono distribuiti in diverse concentrazioni nel cuore (prevalentemente β1), nei polmoni (prevalentemente β2) e nei tessuti periferici.57 Alla luce dei risultati sopra menzionati, l’utilizzo dei β-bloccanti cardio-selettivi può essere valutato nei pazienti con SC e BPCO. I risultati di una meta-analisi, ad esempio, hanno dimostrato come i β-bloccanti cardio-selettivi, in mono-somministrazione o per una lunga durata di terapia, come ad esempio il bisoprololo, non causino dei cambiamenti del FEV1 o l’insorgenza di sintomi respiratori rispetto alla somministrazione di placebo, così come non inficiano la risposta alla terapia con β2-agonisti e, pertanto, sarebbero da preferire nei pazienti con BPCO.54, 55, 57, 61
I risultati sembrerebbero essere similari anche per i pazienti con asma ma in questo caso la cautela è necessaria e condiziona un sottoutilizzo dei β-bloccanti nelle persone con asma. La farmacologia dei β1-bloccanti cardioselettivi indica che la cardioselettività non è completa. Piccole riduzioni della funzione polmonare sono state osservate dopo dosi singole di β-bloccanti nelle persone con asma, ma questo effetto avverso sembra risolversi con il proseguimento del trattamento. L’utilizzo dei β-bloccanti cardio-selettivi, infatti, non sembrerebbe essere associato ad una incidenza aumentata di riacutizzazione di asma e nemmeno ad una aumentata mortalità nei pazienti con asma.62, 63
Se c’è un’indicazione clinica e la possibilità di un evidente beneficio clinico in pazienti con asma bronchiale, il suggerimento è quello di utilizzare β1-bloccanti altamente selettivi, come il bisoprololo, alla dose efficace più bassa sotto stretto controllo specialistico.62
3.6 Scompenso cardiaco e arteriopatia obliterante periferica cronica
Statement
20. Nei pazienti con arteropatia obliterante periferica cronica non esistono controindicazioni assolute alla terapia con β-bloccanti, fatta eccezione per i pazienti con ischemia critica
Essendo provocata da fattori di rischio similari, l’arteriopatia obliterante periferica cronica è una frequente comorbidità nei pazienti con SC.64 Pertanto, molti dei pazienti con arteriopatia obliterante periferica cronica hanno una potenziale indicazione alla terapia con β-bloccanti. Anche se le evidenze a disposizione ad oggi sono molto limitate, i risultati di una meta-analisi hanno riportato come l’utilizzo dei β-bloccanti non sembrerebbe essere associato ad una riduzione della distanza di camminata, del flusso arterioso distale e ad un aumento delle resistenza vascolari distali nei pazienti con claudicatio intermittens.65 Inoltre, l’utilizzo dei β-bloccanti in tale scenario clinico sembrerebbe essere associato ad una riduzione del 53% del rischio di un nuovo evento ischemico cardiaco.66 Nonostante ciò, l’utilizzo di tali farmaci nei pazienti con ischemia critica dell’arto deve essere valutato con estrema cautela.
3.7 Scompenso cardiaco e diabete mellito
Statement
21. Nel caso di pazienti con diabete mellito di tipo II che assumono farmaci che potrebbero esporre a rischio di ipoglicemie (es. sulfaniluree), esiste comunque l’indicazione a terapia con β-bloccanti, con una prescrizione ad un più attento monitoraggio della glicemia e con l’indicazione ad una rivalutazione della terapia ipoglicemizzante.
L’utilizzo dei β-bloccanti sembrerebbe essere associato ad un rischio aumentato di ipoglicemia grave e sostenuta nei pazienti con diabete mellito in terapia a causa della riduzione dei sintomi adrenergici associati a tale situazione.67 Al contrario, alcuni studi hanno dimostrato come i β-bloccanti possano avere un ruolo nel prevenire altre gravi complicanze dell’ipoglicemia grave quali l’ipertensione arteriosa, l’ipopotassiemia o le aritmie potenzialmente fatali senza alterare il controllo glicemico.68, 69 Nei pazienti con diabete mellito in terapia con β-bloccanti e farmaci che potrebbero esporre a rischio di ipoglicemia, sarebbe auspicabile eseguire un attento monitoraggio della glicemia per ridurre il rischio di complicanze gravi. È comunque da sottolineare come le ultime Linee Guida sul diabete sottolinei la necessità di eliminare la prescrizione dei farmaci antidiabetici gravati di rischio ipoglicemico per dare l’assoluta precedenza a metformina, antagonisti del recettore GLP-1 e, in particolare nei pazienti con scompenso cardiaco, gli inibitori SGLT2.70
4. Conclusioni
I β-bloccanti giocano un ruolo fondamentale nella gestione terapeutica del paziente con SC in quanto associati ad un considerevole miglioramento clinico e ad una sostanziale riduzione della mortalità e morbilità. La titolazione graduale del β-bloccante è un procedimento fondamentale della gestione terapeutica dello SC per assicurare l’aderenza alla terapia prescritta e ridurre la possibile insorgenza di effetti collaterali, soprattutto nei pazienti con particolari comorbidità come, ad esempio, la BPCO o l’asma, l’arteriopatia obliterante cronica, il diabete mellito o nei pazienti con età avanzata. Il raggiungimento della “dose target”, definita dagli studi randomizzati e controllati, o di almeno di un “effetto target” con frequenza cardiaca in ritmo sinusale < 70 bpm è fondamentale per garantire la massima efficacia terapeutica. Le indicazioni di pratica clinica riportate all’interno di questo documento rappresentano un utile e pratico strumento clinico in quanto sono state redatte sulla base delle evidenze scientifiche ad oggi a disposizione e del parere di Esperti.
Gli autori ringraziano tutti i membri del Comitato Scientifico per la loro partecipazione e il loro contribuito al metodo Delphi applicato in questa pubblicazione.
Il Comitato Scientifico è composto da:
Alessandro Capucci
Professore Ordinario in Cardiologia Università Politecnica delle Marche, Ancona | Direttore SOD Clinica di Cardiologia e Aritmologia Ospedali Riuniti, Ancona
Francesco Giallauria
Professore Associato di Medicina Interna, Dipartimento di Scienze Mediche Traslazionali, Università di Napoli Federico II
Luigi Di Lorenzo
Direttore UOC Cardiologia e UTIC Ospedale Civile di Sessa Aurunca (CE)
Gerardo Mancuso
Direttore SOC Medicina Interna Ospedale Giovanni Paolo II, Lamezia Terme (CZ) | Direttore UOC Medicina Interna-Lungodegenza Ospedale di Soveria (CZ) | Vice Presidente Nazionale SIMI (Società Italiana di Medicina Interna)
Marco Marini
Dirigente Medico SOD Cardiologia Ospedaliera e UTIC; Responsabile SOS Terapia Intensiva Cardiologica, AOU Ospedali Riuniti di Ancona | Chairperson Area Scompenso Cardiaco ANMCO (Associazione Nazionale Medici Cardiologi Ospedalieri)
Alberto Milan
MD PhD, Professore Associato di Medicina Interna, Università di Torino
Daniele Nassiacos
Direttore UOC Cardiologia - UTIC Ospedale di Saronno - ASST Valle Olona (VA)
Massimo Francesco Piepoli
Direttore UOC Cardiologia Clinica, Policlinico S. Donato IRCCS, Università degli Studi di Milano | Vice presidente ESC (European Society of Cardiology)
Pasquale Predotti
Responsabile Centro Ipertensione Arteriosa AOU San Giovanni di Dio e Ruggi D’Aragona, Salerno
Per il supporto all’applicazione del metodo e all’attività di medical writing si ringraziano rispettivamente la Dr.ssa Ludovica Cimini, MD, Medicina Vascolare d’Urgenza, Stroke Unit, Ospedale Santa Maria della Misericordia, Università degli studi di Perugia e
il Dr. Emanuele Valeriani, MD, Medicina Interna UO Malattie Infettive, Azienda Ospedaliera Universitaria, Policlinico Umberto I, Roma
Si ringrazia Recordati per il contributo incondizionato


Lascia un commento