Il mondo è attualmente colpito dalla diffusione della pandemia dovuta al virus SARS-CoV-2 che causa la ormai nota sindrome respiratoria acuta grave, definita come COVID-19. Numerosi sforzi sono stati messi in atto per superare la morbilità e la mortalità causate da questo nuovo virus. Tuttavia, questi sforzi sono stati ostacolati dalla mancanza di conoscenza del virus SARS-CoV-2, in particolare per quanto riguarda la virulenza, i fattori di rischio individuali, per definire il trattamento appropriato. Nonostante ciò, è sorprendente come in un tempo relativamente breve siano stati approntati numerosi trattamenti efficaci, che vanno dalla prevenzione con i vaccini, ai trattamenti indiretti, come gli anticorpi monoclonali, fino ad arrivare a trattamenti diretti, come i nuovi antivirali.
È ormai chiaro che la malattia inizia in modo paucisintomatico e, in alcuni casi, può arrivare a livelli potenzialmente letali; è, altrettanto chiaro, che l’aumento dell’incidenza di casi potenzialmente letali causati da SARS-CoV-2 sono, almeno in parte, la conseguenza di una “tempesta di citochine”. In questa breve revisione, ci focalizzeremo sui trattamenti della fase iniziale della sindrome COVID-19 e, in particolare, sul ruolo dei farmaci antinfiammatori non steroidei (FANS) nella terapia precoce.
Bisogna ricordare che i FANS hanno avuto fortune alterne nella terapia del COVID-19. Le preoccupazioni sono emerse dopo che il Ministero della Salute francese ha emesso un parere, il 14 marzo 2020, per evitare l’uso di FANS, in particolare ibuprofene, per trattare i sintomi del COVID-19.1 Ciò ha innescato un grande dibattito all’interno della comunità scientifica molto amplificato all’interno dei social e dei media, ulteriormente propagato dall’evidenza che l’ibuprofene sembra essere associato ad una sovraregolazione di ACE2,2 il recettore dove SARS-CoV-2 si aggancia, aumentando potenzialmente la suscettibilità al virus. Questo ha determinato un aumento dell’uso di paracetamolo causandone una carenza globale,3 lasciando ai medici delle cure primarie una scelta limitata per i trattamenti sintomatici. Il problema si è ridimensionato in breve tempo con il comunicato emesso dal Comitato per la sicurezza dei farmaci dell’EMA (PRAC), il 18 marzo del 2020, a seguito della revisione sulla sicurezza avviata l’anno precedente sui medicinali antinfiammatori non steroidei, nel quale si sostiene, in linea con le Linee Guida terapeutiche nazionali dell’UE, che non vi sono elementi clinici per non utilizzare i FANS nei pazienti con COVID.4
FANS e infezioni virali
I FANS agiscono attraverso l’inibizione degli enzimi della ciclossigenasi (COX), che catalizzano la conversione in due fasi dell’acido arachidonico in trombossano, prostaglandine e prostacicline.1 Attualmente, sono riconosciuti due tipi di COX: COX-1, costitutivamente espressa nell’organismo e coinvolta nelle funzioni omeostatiche, comprese quelle relative alla protezione della mucosa gastrointestinale, alla funzione renale e alle piastrine; COX-2, che viene espressa durante una risposta infiammatoria e in cui vengono prodotti mitogeni e citochine.
I FANS, oltre alla loro azione antalgica e antipiretica, potrebbero avere un ruolo importante nel contrastare l’isoforma COX-2, enzima importante coinvolto in numerosi processi fisiologici e patologici.
In particolare, nelle infezioni virali COX-2 svolge un ruolo critico, tramite la regolazione dei livelli di espressione di molte proteine sieriche,5 giocando un ruolo importante nella polmonite alveolare, interstiziale di origine virale e nell’infiammazione sistemica. È stato dimostrato che COX-2 ha un effetto importante sulle citochine pro-infiammatorie e la sua inibizione non attenua la risposta immunitaria contro le malattie virali.
Esiste una vasta letteratura che dimostra che nelle infezioni virali e, in particolare, nell’influenza, esiste una iperespressione di COX-2 e che l’utilizzo di FANS porta benefici clinici.6-9 In particolare, per quanto riguarda i coronavirus, è stato dimostrato che nella sindrome respiratoria acuta grave (SARS) le proteine S e N del nucleocapside virale inducono COX-2 nelle cellule dei mammiferi.10,11 Questo rappresenta un punto cardine per indurre successive cascate infiammatorie intracellulari che esitano in cascate intercellulari. L’inibizione di COX da parte dei FANS porta a benefici, sia per la riduzione dei sintomi sia per la progressione della malattia. Tuttavia, sembra che l’inibizione della COX-2 sia più rilevante rispetto all’inibizione della COX-1.12,13
L’inibizione farmacologica della COX-2 da parte dei FANS diminuisce i livelli di TNF-α, G-CSF e IL-6 senza un aumento significativo dei titoli virali nel liquido di lavaggio broncoalveolare nei topi con infezione da influenza A.14,15
Molti di questi effetti critici legati all’iperespressione di COX- 2 potrebbero essere controllati dai FANS. Questi passaggi fisiopatologici potrebbero essere particolarmente importanti nella progressione della malattia dallo stadio 1 allo stadio 2, durante il quale molti pazienti possono essere trattati in regime ambulatoriale, impedendo la progressione infiammatoria delle infezioni virali.
Fatta questa premessa legata al ruolo che i FANS potrebbero avere nelle infezioni virali per il loro meccanismo d’azione, si vuole approfondire alcuni aspetti legati al ketoprofene, farmaco di largo impiego che possiede alcune caratteristiche utili per un possibile impiego nel COVID-19.
Ketoprofene
Il ketoprofene, dal punto di vista chimico, appartiene al gruppo dei derivati dell’acido 2-arilpropionico (2-APA) (Figura 1) ed è uno dei farmaci antinfiammatori non steroidei (FANS) più comunemente usati.
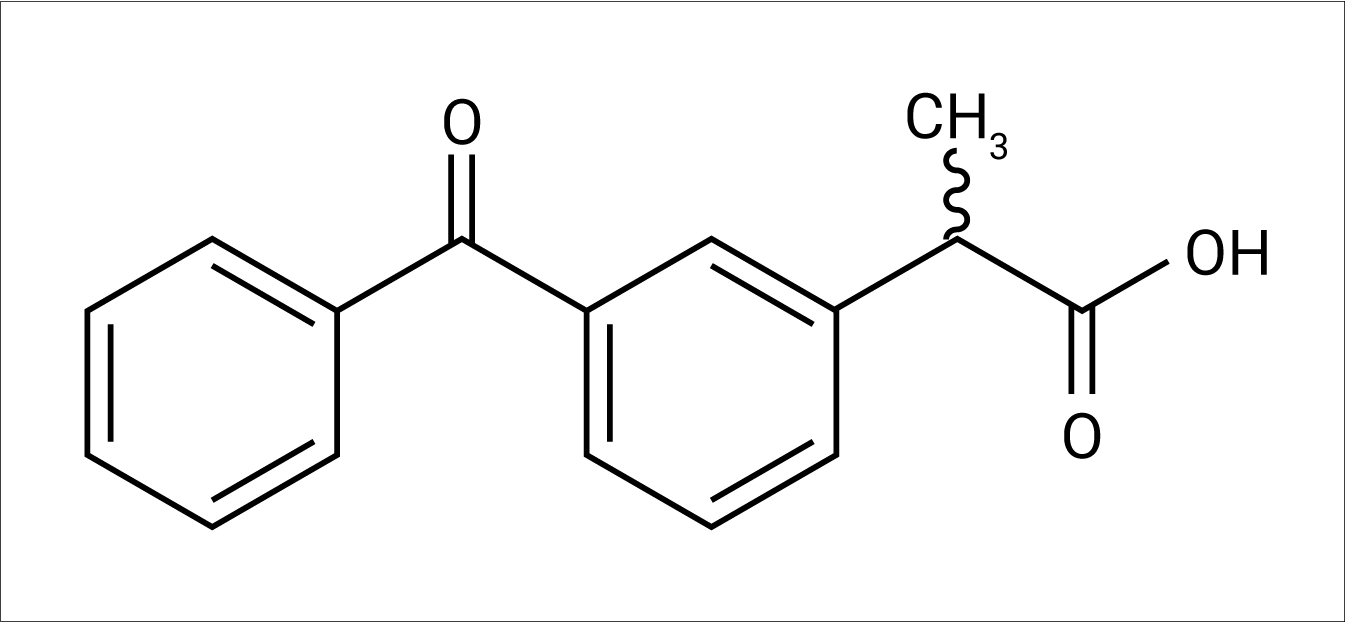 Figura 1. Struttura chimica di ketoprofene.
Figura 1. Struttura chimica di ketoprofene.
Il farmaco possiede tutte le proprietà analgesiche, antinfiammatorie e antipiretiche tipiche della classe.
In particolare, la salificazione del ketoprofene con l’amminoacido lisina ha consentito un miglioramento delle caratteristiche della molecola.16 Ketoprofene sale di lisina (KLS) ha, infatti, una solubilità maggiore rispetto al ketoprofene acido; questa caratteristica facilita un più rapido e completo assorbimento del principio attivo, con un’elevata concentrazione sierica di picco raggiunta dopo 15 minuti dalla somministrazione orale di KLS, rispetto a 60 minuti dopo la somministrazione di ketoprofene.17,18 Il rapido assorbimento del KLS si traduce in una più rapida attività farmacologica, con un’attività analgesica osservata in meno di 30 minuti dopo la prima somministrazione orale, in modalità statisticamente significativa rispetto al placebo.19
Basi razionali per l’impiego di ketoprofene sale di lisina nel COVID-19
Attività antinfiammatoria, antalgica ed antipiretica
L’attività antalgica ed antipiretica del ketoprofene è ampiamente nota.20,21 Il ketoprofene ha dimostrato, in molteplici studi clinici, di avere il più alto rapporto tra effetto antinfiammatorio ed effetto analgesico risultando, tra i FANS non selettivi, il più potente (Figura 2).22,23
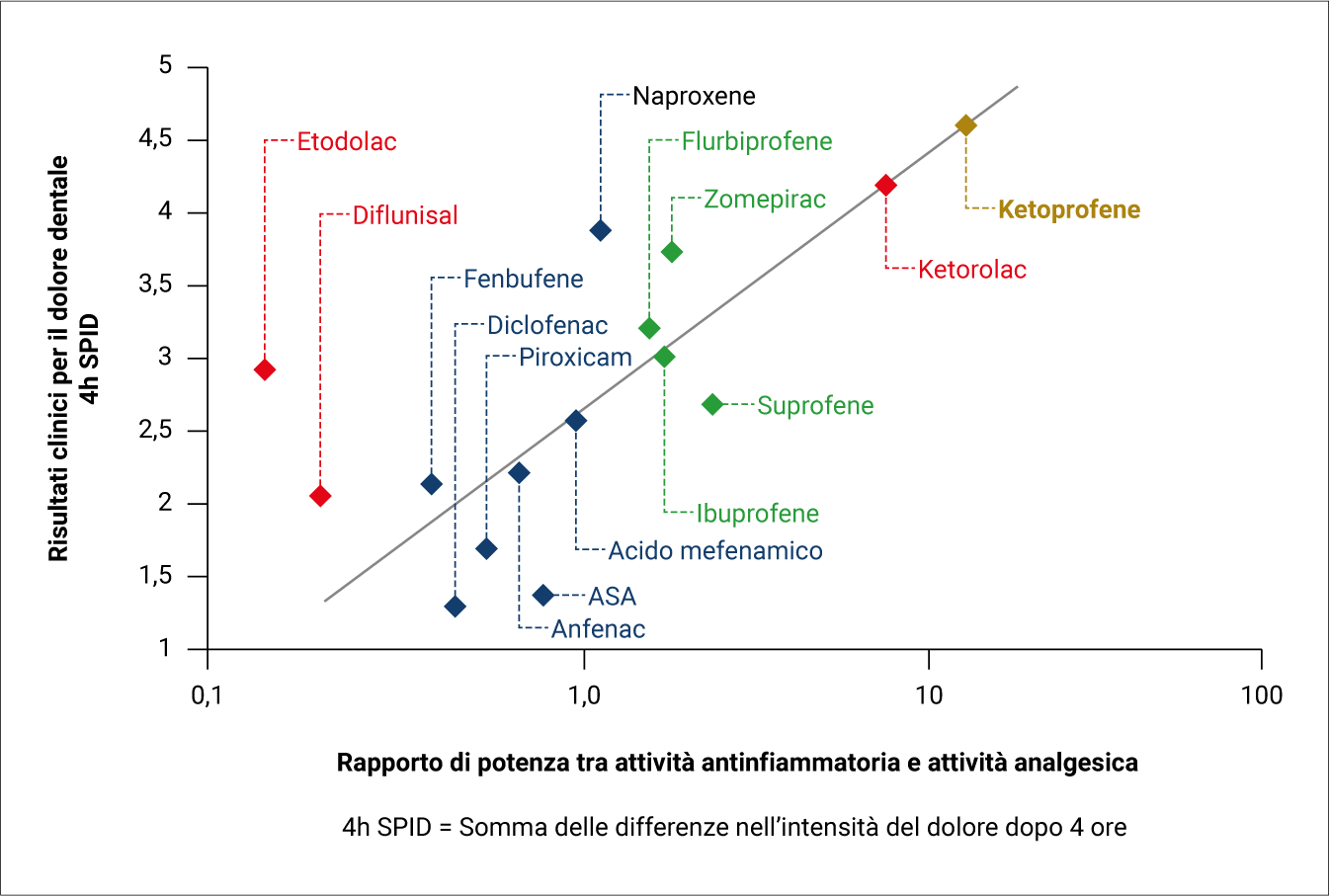 Figura 2. L’efficacia clinica analgesica, in un modello di dolore dentale, a confronto con l’attività antinfiammatoria di differenti FANS. Mettendo in relazione l’efficacia con il rapporto tra effetto antinfiammatorio ed effetto analgesico, il ketoprofene è risultato il migliore rispetto a tutti gli altri FANS con cui è stato confrontato. Questi dati sono stati confermati da una metanalisi condotta su 13 studi controllati randomizzati. Gli autori hanno scoperto che l’efficacia del ketoprofene nel dare sollievo in caso di dolore da moderato a grave è significativamente maggiore rispetto a quella dell’ibuprofene e/o del diclofenac.22
Figura 2. L’efficacia clinica analgesica, in un modello di dolore dentale, a confronto con l’attività antinfiammatoria di differenti FANS. Mettendo in relazione l’efficacia con il rapporto tra effetto antinfiammatorio ed effetto analgesico, il ketoprofene è risultato il migliore rispetto a tutti gli altri FANS con cui è stato confrontato. Questi dati sono stati confermati da una metanalisi condotta su 13 studi controllati randomizzati. Gli autori hanno scoperto che l’efficacia del ketoprofene nel dare sollievo in caso di dolore da moderato a grave è significativamente maggiore rispetto a quella dell’ibuprofene e/o del diclofenac.22
Un altro aspetto interessante di questa molecola, il ketoprofene, è la capacità di inibire l’aggregazione piastrinica e la produzione di trombossano B(2), che è sovrapponibile a quella ottenuta dall’aspirina.24 Questo effetto è di particolare importanza nell’ambito del COVID-19, in particolare perché è stato ampiamente dimostrato che, durante la tempesta citochinica, l’endotelio dei vasi sanguigni si attiva, riducendo la produzione di prostacicline e ossido nitrico, due importanti fattori antiaggreganti; in questa fase, vengono rilasciate nel flusso sanguigno microvescicole con elevato potenziale protrombotico, portando ad un aumento dell’aggregazione piastrinica, con formazione di microaggregati che possono ostruire il microcircolo polmonare.
La capacità antiaggregante di un FANS nelle fasi precoci della malattia, pertanto, risulta essere di particolare importanza clinica, in particolare, nella progressione della patologia e va considerata come uno dei fattori potenzialmente differenzianti nella scelta del FANS. Questo effetto, infatti, non è comune a tutti i FANS: ad esempio, ibuprofene ha un effetto antiaggregante piastrinico basso o, addirittura, trascurabile.25
Come sottolineato, l’effetto primario dei FANS nel contrastare l’infiammazione dovuta alle infezioni virali, si esercita attraverso l’inibizione della COX-2. Il paradigma attuale è che la COX-2 è indotta dalle citochine che si liberano, in seguito all’infezione virale.26,27
La COX-2, una volta indotta, guida e mantiene la cascata proinfiammatoria attraverso un complesso ciclo di feedback positivo durante l’infezione virale.28 L’impiego di FANS COX-2 inibitori ha mostrato di ridurre la cascata infiammatoria, sia in altre infezioni virali respiratorie sia nel COVID-19.29-31
Ketoprofene è un FANS non selettivo con un’elevata attività sulla COX-2, che è tra le più potenti tra i FANS utilizzati nel COVID-19 (Tabella 1); questo elemento è una base farmacologica importante per un possibile razionale di impiego di ketoprofene nel COVID-19. Inoltre, dalla Tabella 1 emerge che, oltre alla potente azione su COX-2, ketoprofene ha una buona azione su COX-1. Elemento chiave nell’approccio farmacologico è il buon bilanciamento di azione su COX-1 e COX-2, in grado di ridurre il rischio trombotico. In particolare, è noto che gli inibitori altamente selettivi della COX-2 (noti anche come coxib) sono stati associati al maggior rischio di effetti vascolari avversi32 e, inoltre, mancano di un equilibrio di inibizione tra le due isoforme di COX.
 Tabella 1. Concentrazione di alcuni FANS (IC50) che ha inibito il 50% dell’attività della ciclossigenasi (COX) nel sangue.39
Tabella 1. Concentrazione di alcuni FANS (IC50) che ha inibito il 50% dell’attività della ciclossigenasi (COX) nel sangue.39
È importante anche ricordare che il ketoprofene si distribuisce rapidamente e prontamente in tutti i tessuti, incluso il sistema nervoso centrale, superando la barriera ematoencefalica in 15 minuti, grazie al suo alto livello di liposolubilità.33,34 Le caratteristiche di liposolubilità del ketoprofene gli consentono di entrare anche nel tessuto adiposo. Questo dato assume una certa importanza nel COVID-19; infatti, è stato recentemente dimostrato che il tessuto adiposo è sede di invasione da parte del virus SARS-CoV-2, ma ancora più importante è fonte di attività proinfiammatoria.35 In base a questo dato e da quanto citato sopra, esiste un forte razionale per ipotizzare che il ketoprofene abbia un’elevata attività nel prevenire la progressione delle malattie virali respiratorie e, in ogni caso, almeno pari ai FANS proposti o utilizzati nel COVID-19, inclusi quelli selettivi sulla COX-2.36-38
Appare interessante, a questo punto, riportare alcune note sulla tollerabilità del ketoprofene.
Tollerabilità gastrica
È noto che l’effetto lesivo dei FANS sulla mucosa gastrica è legato alla loro capacità di inibire la COX-1. Il ketoprofene base è diverso dal ketoprofene sale di lisina (KLS), sia in termini farmacocinetici sia in termini di tollerabilità gastrica. Infatti, il KLS, oltre a migliorare la farmacocinetica del ketoprofene, offre vantaggi a livello della mucosa gastrica. La presenza di L-lisina in KLS determina un effetto meno dannoso del farmaco sullo strato della mucosa gastrica; è stato ampiamente dimostrato che la lisina contrasta il danno sulla mucosa gastrica, indotto sia dall’etanolo sia dai FANS, regolando le proteine gastroprotettive (Figura 3).40
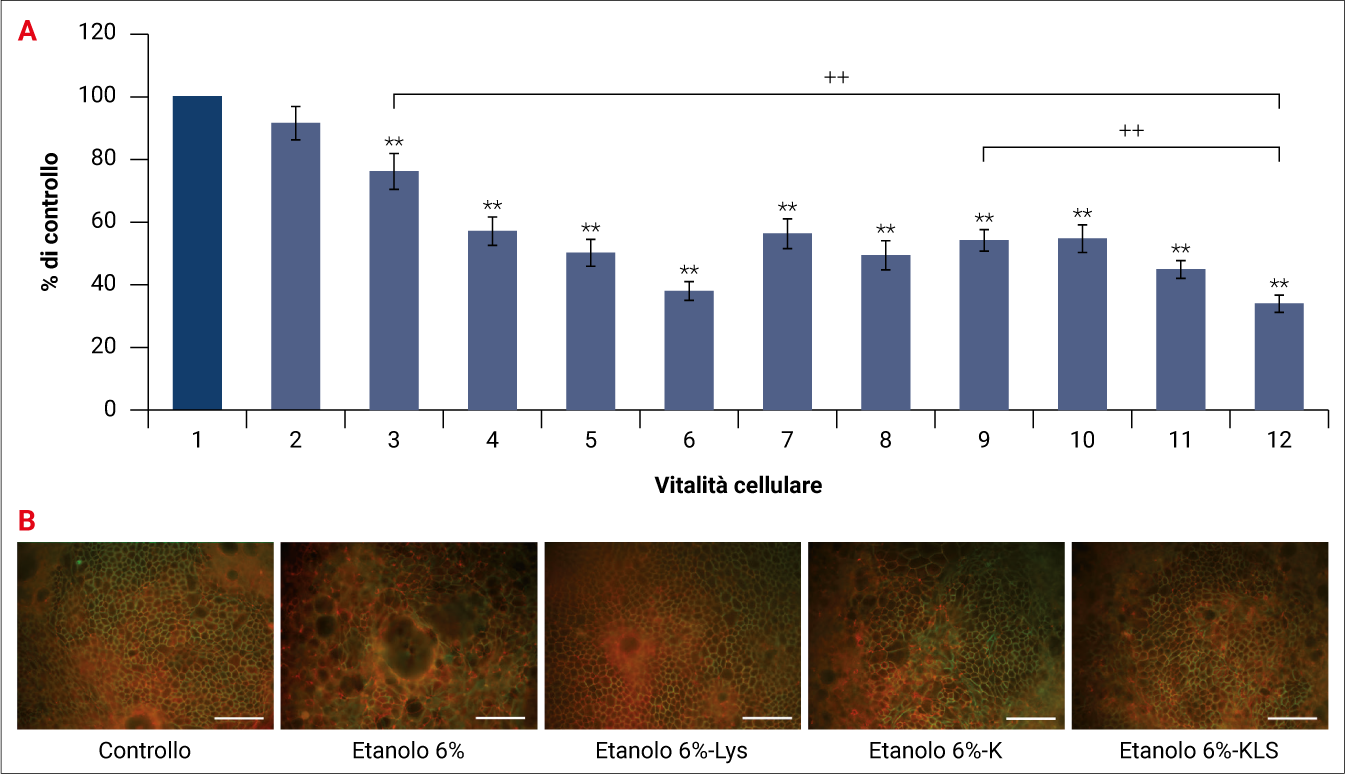 Figura 3. (A) L’effetto protettivo di KLS sull’epitelio gastrico su cellule NCI-N87 trattate con etanolo al 6% per 72 ore. In figura viene riportato l’effetto dell’etanolo somministrato da solo o in combinazione con 250 mM di ketoprofene (K) o ketoprofene sale di lisina (KLS). Il trattamento con K si traduce in una significativa diminuzione della vitalità cellulare dipendente dal tempo alla concentrazione di etanolo del 6% utilizzata, mentre il trattamento con KLS è risultato protettivo dopo 72 ore di incubazione rispetto all’etanolo. L’effetto protettivo della L-lisina sull’epitelio gastrico potrebbe spiegare la minore gastrotossicità del KLS, rispetto a K.
1: cellule di controllo; 2: cellule trattate con lisina; 3: cellule trattate con etanolo; 4: cellule trattate con etanolo e lisina; 5: etanolo e ketoprofene 24 h; 6: etanolo e ketoprofene 48 ore; 7: etanolo e ketoprofene 72 ore; 8: etanolo e KLS 24 ore; 9: etanolo e KLS 48 ore; 10 etanolo e KLS 72 ore. ** P minore di 0,001.40
Figura 3. (A) L’effetto protettivo di KLS sull’epitelio gastrico su cellule NCI-N87 trattate con etanolo al 6% per 72 ore. In figura viene riportato l’effetto dell’etanolo somministrato da solo o in combinazione con 250 mM di ketoprofene (K) o ketoprofene sale di lisina (KLS). Il trattamento con K si traduce in una significativa diminuzione della vitalità cellulare dipendente dal tempo alla concentrazione di etanolo del 6% utilizzata, mentre il trattamento con KLS è risultato protettivo dopo 72 ore di incubazione rispetto all’etanolo. L’effetto protettivo della L-lisina sull’epitelio gastrico potrebbe spiegare la minore gastrotossicità del KLS, rispetto a K.
1: cellule di controllo; 2: cellule trattate con lisina; 3: cellule trattate con etanolo; 4: cellule trattate con etanolo e lisina; 5: etanolo e ketoprofene 24 h; 6: etanolo e ketoprofene 48 ore; 7: etanolo e ketoprofene 72 ore; 8: etanolo e KLS 24 ore; 9: etanolo e KLS 48 ore; 10 etanolo e KLS 72 ore. ** P minore di 0,001.40
(B) KLS protegge la morfologia cellulare e l’integrità delle giunzioni delle cellule dell’epitelio gastrico. Adesione e integrità cellulare valutata attraverso saggi di immunofluorescenza per E-caderina, marcatore delle giunzioni aderenti (verde), e ZO-1, marcatore di giunzioni strette (rosso) in monostrati della linea cellulare epiteliale gastrica umana NCI-N87, in seguito al trattamento rispettivamente con etanolo, etanolo/L-lisina, etanolo/K ed etanolo/KLS per 72 ore. Le cellule trattate con etanolo hanno riportato un evidente danneggiamento della membrana che risulta in una perdita delle giunzioni strette. Il trattamento con L-lisina assicura la protezione della morfologia cellulare e l’integrità delle giunzioni. In accordo con questa evidenza, le cellule trattate con etanolo e ketoprofene base appaiono gravemente danneggiate con perdita dell’integrità tissutale, mentre le cellule trattate con etanolo e KLS vengono preservate dal danno da etanolo.40
Questo meccanismo è alla base della ridotta gastrotossicità segnalata di KLS, rispetto alla forma non salificata del farmaco, come pure verso altri FANS.41 In un recente studio in vitro di confronto, infatti, è stato dimostrato che ibuprofene risulta significativamente più dannoso sulla mucosa gastrica, rispetto a ketoprofene acido; inoltre, l’aggiunta di lisina al ketoprofene dimostra un significativo effetto gastroprotettivo, mentre l’arginina associata a ibuprofene è risultata inefficace nel contrastare il danno indotto da etanolo.41
Tollerabilità cardiovascolare
Con l’avvento dei FANS selettivi sulla COX-2, è emerso il rischio di eventi avversi a livello cardiovascolare; in seguito, vari studi hanno evidenziato che tale rischio era presente anche in FANS non selettivi.42-44 Per quanto riguarda il ketoprofene, oggetto della nostra trattazione, diversi studi e metanalisi, compreso lo studio S.O.S. (Safety of NSAIDs), uno dei più grandi studi effettuati a livello internazionale sulla tollerabilità dei FANS, commissionato da EMA che ha coinvolto 8,9 milioni di pazienti trattati con FANS, hanno evidenziato che il farmaco non produce effetti negativi a livello cardiovascolare, mostrando un profilo di tollerabilità migliore rispetto a molti altri FANS di uso comune.45,46 A questo proposito, un recente studio, applicando un modello molto elegante, supporta l’ipotesi che i cardiomiociti umani esposti al ketoprofene non mostrano segni di sofferenza; al contrario, l’esposizione al diclofenac innesca la morte cellulare (Figura 4).47
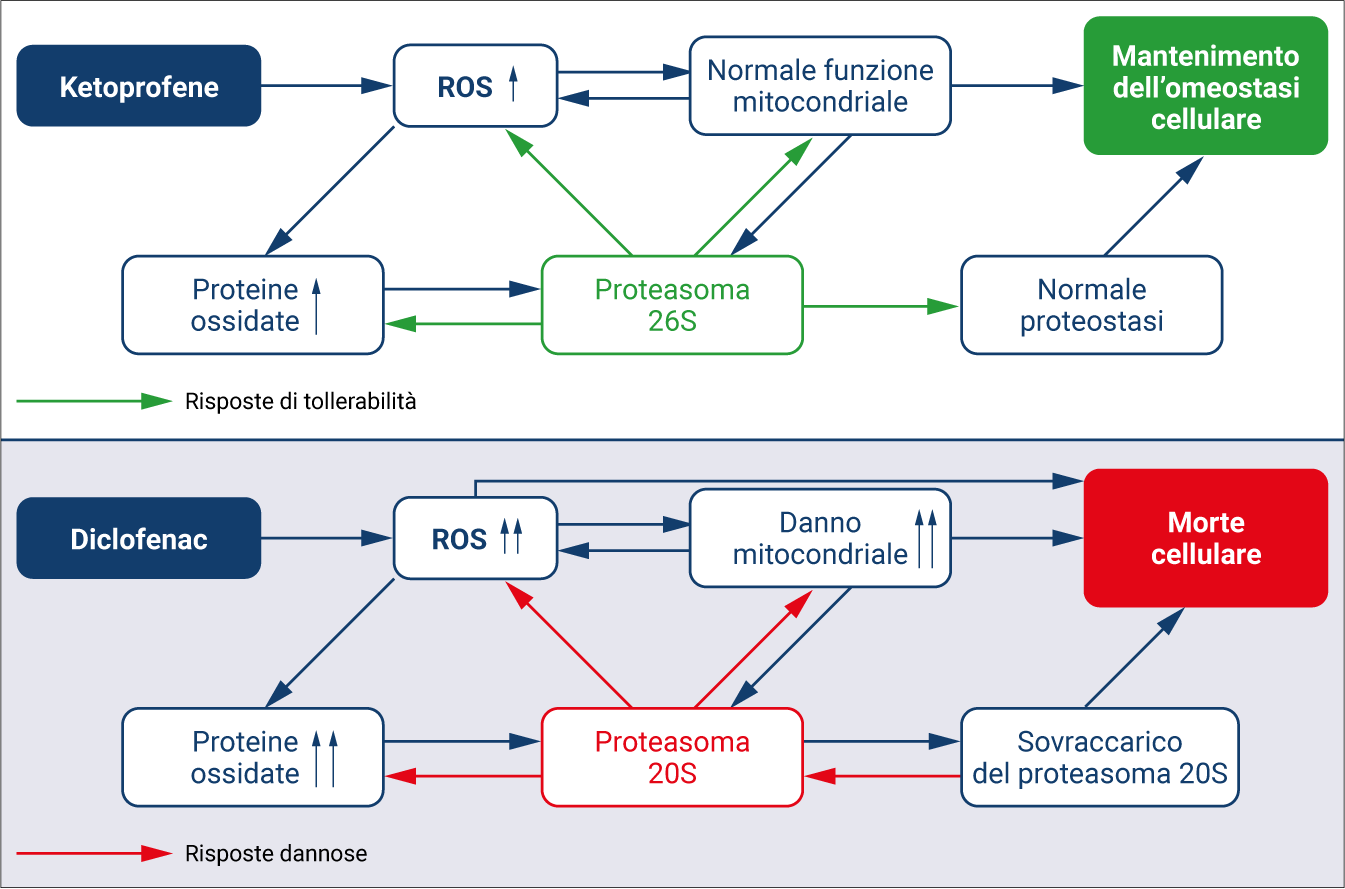 Figura 4. Rappresentazione schematica del meccanismo proposto rispettivamente per ketoprofene e diclofenac nei cardiomiociti umani. Il ketoprofene non ha influenzato la vitalità cellulare, mentre diclofenac induce morte cellulare per apoptosi. Il meccanismo probabilmente è legato all’effetto dei due farmaci sui mitocondri. Ketoprofene non aumenta i ROS mitocondriali, ma diminuisce leggermente il potenziale di membrana mitocondriale (MMP), senza influenzare il numero dei mitocondri. Al contrario, diclofenac aumenta i ROS mitocondriali, riducendo il numero dei mitocondri e il MMP in maniera drastica. A causa dell’elevato stress indotto da ROS, vi è un sovraccarico del proteasoma 20s. Le cellule trattate con diclofenac non sono in grado di innescare una risposta citoprotettiva, favorendo così la probabilità di morte cellulare per apoptosi. Quando, invece, i cardiomiociti umani vengono esposti a ketoprofene, questi sono in grado di tollerare bene lo stress e, pertanto, sono in grado di preservare l’attività proteolitica del proteasoma.47
Figura 4. Rappresentazione schematica del meccanismo proposto rispettivamente per ketoprofene e diclofenac nei cardiomiociti umani. Il ketoprofene non ha influenzato la vitalità cellulare, mentre diclofenac induce morte cellulare per apoptosi. Il meccanismo probabilmente è legato all’effetto dei due farmaci sui mitocondri. Ketoprofene non aumenta i ROS mitocondriali, ma diminuisce leggermente il potenziale di membrana mitocondriale (MMP), senza influenzare il numero dei mitocondri. Al contrario, diclofenac aumenta i ROS mitocondriali, riducendo il numero dei mitocondri e il MMP in maniera drastica. A causa dell’elevato stress indotto da ROS, vi è un sovraccarico del proteasoma 20s. Le cellule trattate con diclofenac non sono in grado di innescare una risposta citoprotettiva, favorendo così la probabilità di morte cellulare per apoptosi. Quando, invece, i cardiomiociti umani vengono esposti a ketoprofene, questi sono in grado di tollerare bene lo stress e, pertanto, sono in grado di preservare l’attività proteolitica del proteasoma.47
Conclusioni
I FANS hanno avuto un inizio controverso nel COVID-19, per poi essere rapidamente e pienamente riabilitati. Oggi, possiamo affermare che non esistono prove di un effetto dannoso dei FANS prescritti di routine, né sulla progressione della malattia né sulla morte correlata al COVID-19. Le persone che, attualmente, usano FANS per le loro condizioni cliniche dovrebbero continuare il trattamento come parte delle loro cure di routine.
In più, i FANS assunti in fase iniziale potrebbero migliorare l’andamento della malattia. Il ketoprofene sale di lisina, in particolare, possiede caratteristiche di elevata efficacia antinfiammatoria, antipiretica, antalgica e un particolare effetto antiaggregante piastrinico, unitamente a caratteristiche farmacologiche di liposolubilità e di equilibrio nell’inibizione delle due isoforme della ciclossigenasi, che lo rendono, tra i FANS, un farmaco da preferire nel trattamento delle infezioni virali respiratorie, incluso il COVID-19. È, comunque, necessario seguire le comuni raccomandazioni di impiego dei FANS, usando le dosi più basse possibili e per il periodo necessario.
Si ringrazia Dompé Farmaceutici per il contributo incondizionato.


Lascia un commento